
Почти сто лет назад немецкий эмбриолог Ханс Шпеман, демонстрируя удивительное терпение и мастерство, проводил эксперименты на эмбрионах шпорцевой лягушки. С помощью тончайших иголочек и микропипеток он пересаживал зачаток глаза одного зародыша в различные участки тела другого. Удивительно, но кожа пересаженного зачатка везде превращалась в роговицу. Это навело Шпемана на мысль, что различные части эмбриона выделяют вещества, влияющие на развитие соседних областей. В результате ученый сформулировал теорию "организующих центров", описав различные точки зародыша, за что получил Нобелевскую премию по физиологии и медицине в 1935 году.
Таким образом, стало понятно, что иногда встречающиеся "чудища" с двумя головами — это не всегда сросшиеся близнецы, а возможно, единый организм со сбившейся программой "организующего центра". Ханс Шпеман описал эту ситуацию так: возникает дополнительный "организующий центр", который посылает сигналы о том, что голова должна вырасти в такой-то точке, несмотря на наличие на противоположном конце такой же формирующейся головы. Сейчас, через 100 лет после опытов Шпемана, ученые полностью убедились в его правоте. Кроме того, они уже знают, какие именно гены отвечают за появление "организующих центров". Они могут определить эти гены, понять, какой "продукт", то есть белок, они производят, и вколоть его в любое место на формирующемся теле. И именно там начнет развиваться дополнительный орган, например, вырастет голова!
Как же это происходит? Задача развития достаточно трудная: нужно сформировать сложный многоклеточный организм в трехмерном пространстве, точно определив, в каком месте и в какую сторону будут расти ноги, руки, голова. Ошибка такого трехмерного моделирования может привести к непоправимым последствиям. Получается, что в сгустке клеток, которые поначалу и представляют собой эмбрион, должен быть "вмонтирован" некий "компас", который не только определяет, где находятся север, юг, верх и низ, но и координирует передвигающиеся и делящиеся клетки в онлайн-режиме.
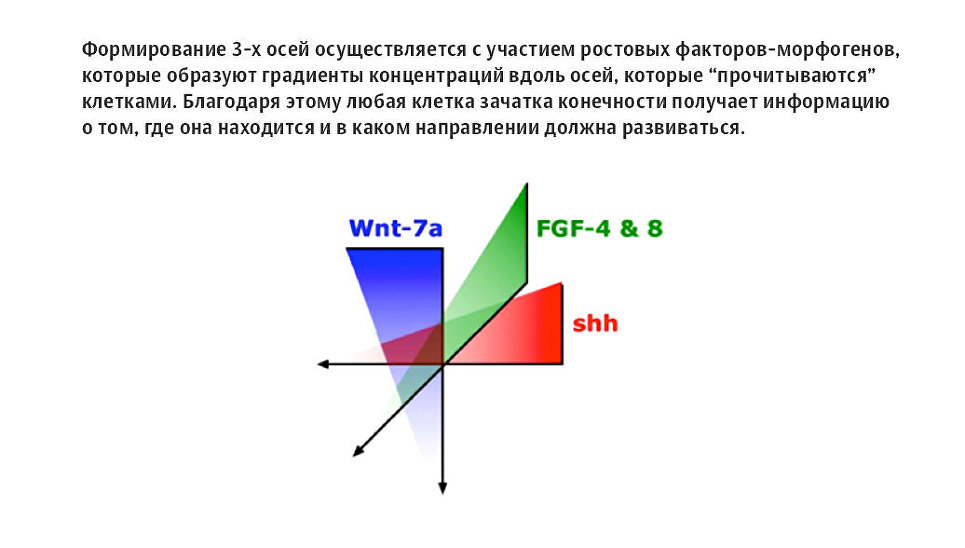
Схема формирования осей полярности в эмбрионе
Как выяснили ученые, эта работа происходит с помощью "прокладывания" осей полярности, которые представляют собой "дорожки" веществ с постепенно снижающейся концентрацией (градиент концентрации). Первая такая ось прокладывается еще в зиготе — самой первой клетке, содержащей полный двойной набор хромосом в результате слияния яйцеклетки и сперматозоида.
Дальше образование этих осей сопровождает все этапы развития — становится понятно, где располагаются спина, живот, где должны быть голова и ноги. Оси полярности есть и у каждого органа. Именно так клетки координируются между собой, перемещаясь по "выложенным дорожкам" нужных веществ, которые называются морфогенами. Концентрация морфогена — это и есть понятная для клеток позиционная информация. Каждая клетка, реагирующая на "индивидуальный" градиент концентрации, "понимает", где она находится, и активирует работу совершенно уникального набора генов, которые запускают развитие нового органа, вначале представлявшего собой бугорок.

На этой схеме показано, как работают НОХ-гены в бугорках, из которых потом сформируются конечности курицы
Так кто же запускает оси полярности? Кто является "руководителем" в "организующих центрах", о которых писал еще Ханс Шпеман почти 100 лет назад? На этот вопрос пока убедительных ответов у ученых нет. Однако во многих лабораториях ведутся опыты, в которых экспериментаторы пробуют на самом раннем этапе развития эмбриона отключить тот или иной ген, формирующий ось полярности.

На слайде показаны конечности, которые сформировались при нарушениях в работе осей полярности
Поясняет профессор кафедры генетики биологического факультета МГУ имени М. В. Ломоносова Татьяна Ежова: "Пробовали отключать ось "плечо — кончики пальцев"(дистально-проксимальную ось) — закономерно идет недоразвитие всех отделов кисти. Если нарушается работа одного из генов, который отвечает за ось "ладонь — тыльная сторона" (дорзо-вентральную ось), прямо на тыльной стороне у лабораторных мышей начинают расти подушечки пальцев. Если экспериментировать с задне-передней осью ("большой палец — мизинец"), вызвав усиленную работу генов полярности, — образуется симметричная структура кисти: так было бы, если по двум сторонам человеческой руки мы имели бы мизинцы или большие пальцы. Если отключить работу гена, прокладывающего эту же ось, то вместо разных по строению костей предплечья, запястья и пальцев образуется по одной кости в каждом отделе. Больше всего таких исследований проведено генетиками на курах и мышах. Но те же гены действуют и при образовании конечностей человека".
Получается, что можно вырастить сколько угодно голов, рук, ног — и клеток на все это хватит? На самом деле, если идет развитие по "сценарию нормы", известно, сколько именно клеток формирует зачаток органа. А вот если происходят отклонения в развитии, могут запуститься любые процессы, в частности, клетки могут начать делиться в неконтролируемых объемах. Таким образом, теоретически зная, как работают "организационные центры", ученые могут смоделировать создание существа любой конфигурации, однако оно будет нежизнеспособным. Ведь эволюция уже давно "опробовала" все эти варианты и остановилась на самых удачных из них.
В это время международная группа исследователей разобрала эмбрионы дрозофил на несколько тысяч отдельных клеток, а потом собрали обратно – но уже в компьютере.
На раннем этапе развития любой эмбрион выглядит как микроскопическая горстка клеток. Все они выглядят одинаково под микроскопом, но каждая уже знает, какой ткани она даст начало, кем будут ее потомки – нейронами, клетками мышц или кем-нибудь еще. Как эмбриональные клетки узнают свою судьбу, откуда берется сложность и разнообразие многоклеточного организма, если он «начинается» с одной-единственной клетки – эти вопросы занимали умы не одного поколения исследователей.
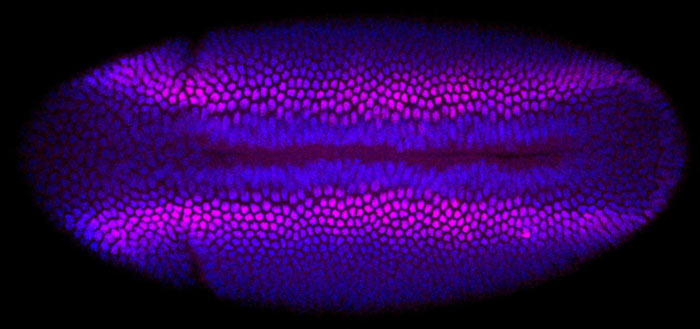
Настоящий эмбрион дрозофилы, в котором начинают формироваться части тела: слева видно, как от туловища начинает отделяться голова.
Одним из тех, кто пытался на них ответить, был Алан Тьюринг, выдающийся математик и логик, стоявший у истоков информатики. В его время о молекулярных принципах работы генов не было известно почти ничего, тем не менее, Тьюринг понимал, что в клетках есть некие химические вещества, которые могут распределяться по ткани неравномерно, так что их концентрация будет в каких-то направлениях нарастать, а в других – уменьшаться (иными словами, концентрации будут распределены по градиентам).
Он предполагал, что подобные различия в концентрации могут каким-то образом превращаться в различия в клеточном «самоопределении». Позже стало понятно, что химические вещества – это продукты экспрессии генов, то есть белки, и что их распределение по клетке (то есть пространственные химические градиенты) – действительно именно то, что позволяет клеткам понять, в каком месте эмбриона они находятся, и выбрать собственный путь развития.
Со временем многое в развитии живого организма стало понятным, и в целом эмбриогенез уже не кажется необъяснимым чудом (по крайней мере, для тех, кто берет себе за труд что-то узнать по теме). Но увы, одновременно стало понятно и то, что у этого процесса нет лаконичного и разборчивого объяснения. Каждое событие в нем обусловлено стольким количеством факторов, такими сложными взаимными влияниями различных генов и условий окружающей среды, что для того, чтобы представить полную картину развития зародыша, необходимо подключить информационные технологии.
Именно так поступили в Берлинском институте медицинской системной биологии, входящем в состав Центра молекулярной медицины Макса Дельбрюка. Исследователи работали с эмбрионом дрозофилы, который после первых тринадцати синхронных клеточных делений состоит из 6000 клеток. Для эмбриона создали виртуальную трехмерную модель с клеточным разрешением. В каждой его клетке хранились данные об активности порядка 8000 генов, так что модель позволяла воссоздавать их трехмерные градиенты в виртуальном теле эмбриона, наблюдая, насколько они перекрываются друг с другом. Полностью результаты исследований опубликованы в Science.
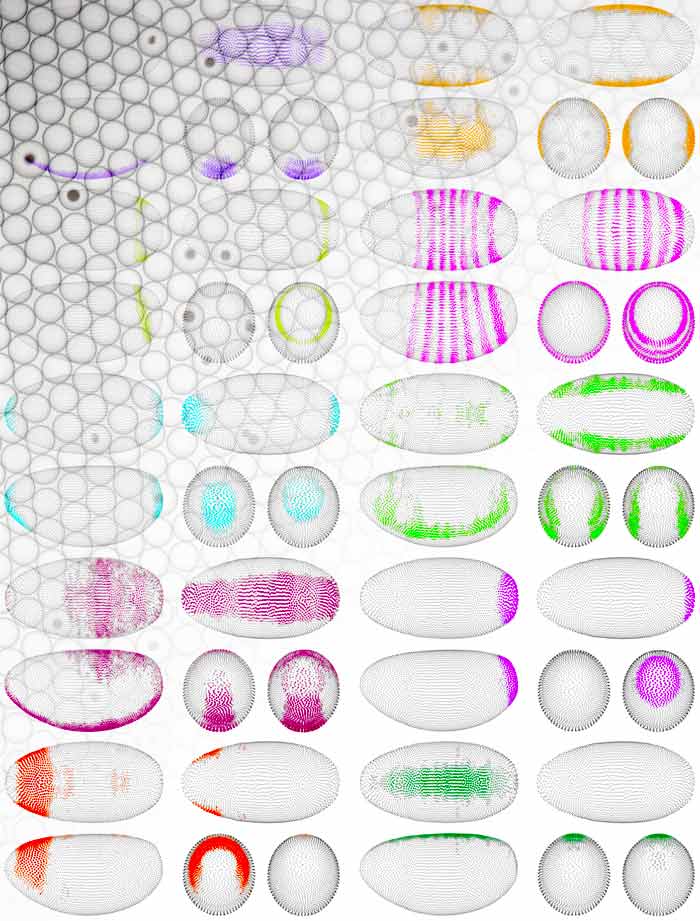
Виртуальный эмбрион дрозофилы в нескольких проекциях; активность различных генов показана разными цветами.
Чтобы получить своего виртуального «питомца», исследователям пришлось вначале разобрать на отдельные клетки около пяти тысяч эмбрионов, находящихся в одной и той же стадии развития. Затем они прочитали все молекулы матричных РНК (мРНК) в каждой клетке – как мы знаем, генетическая информация из ДНК копируется в матричную РНК, с которой потом работают белоксинтезирующие машины; иными словами, зная о том, сколько и какие мРНК плавают в клетке, мы можем с большой долей уверенности судить о том, какие гены в клетке активны, а какие – нет. Данные об РНК превращались в виртуальные клетки, из которых затем реконструировали 3D-эмбрион; естественно, дело не обошлось без специального программного алгоритма, который нужно было создать именно под эту задачу.
По словам Николауса Раевского, руководителя одной из научных групп, работавших над моделью эмбриона, теперь молекулярно-генетические процессы можно изучать не только в кропотливых и длительных опытах с настоящими зародышами, но и в виртуальных экспериментах. Работа, на которую могут уйти годы при использовании традиционных методов исследования, теперь может быть выполнена за пару часов.
Несмотря на то, что человек и дрозофила довольно сильно отличаются друг от друга, большинство фундаментальных биологических механизмов, контролирующих эмбриональное развитие, сохранились в неизменном виде на протяжении тех многих миллионов лет эволюции, которые нас разделяют. И большая часть из того, что мы знаем в области биологии развития, получена в экспериментах на модельных животных, таких, как мыши и дрозофилы.
Наши представления об эмбриональном развитии человека – особенно это относится к поздним стадиям, которые по этическим причинам нельзя изучать на человеческих зародышах – очень часто не что иное, как экстраполяция результатов, полученных на животных. Поэтому созданная исследователями трехмерная модель эмбриона имеет отношение не только к мухам – коль скоро современная эмбриология обязана своим успехам экспериментам на дрозофилах, то виртуальная дрозофила покажется довольно «крутым» инструментом.
Кстати сказать, эмбриология, биология развития нужны нам не только ради самих эмбрионов, у которых мы в ближайшем будущем, очевидно, научимся исправлять разнообразные дефекты развития. Не будем забывать, что вся регенеративная медицина стоит на стволовых клетках, а знания о стволовых клетках, об их взаимоотношениях друг с другом и с другими типами клеток относятся как раз к биологии развития.
Если мы хотим стимулировать регенерацию ткани в месте повреждения или же вообще вырастить орган «с нуля», необходимо понимать, какие гены тут работают и как они друг с другом взаимодействуют. Но процессы, которые активируются при регенерации ткани, очень схожи с тем, что происходит, когда эта ткань возникает во время эмбриогенеза. Поэтому, например, заживление ран вполне успешно изучают на тех же мушиных эмбрионах.
Возвращаясь к 3D-эмбриону, стоит отметить, что пока такая модель построена только для одной временно́й точки. Чтобы получить более подробную модель эмбрионального развития, авторы работы собираются проделать то же самое, но уже для эмбриона, находящегося на других этапах развития, у которого уже начали формироваться органы. Ранее группа учёных установила, что эмбриональные клетки вычисляют свои координаты математически оптимальным способом.
Источники: РИАНАУКА и НАУКА И ЖИЗНЬ

