Наши клетки умирают постоянно, и это вполне естественно: они стареют, они изнашиваются, в конце концов, они часто становятся просто ненужными: например, во время эмбрионального развития множество клеток, выполнив свою работу, должны уступить место другим. При этом клетки умирают не вдруг, а по определённой программе, которая называется апоптоз и которую они сами в себе включают.
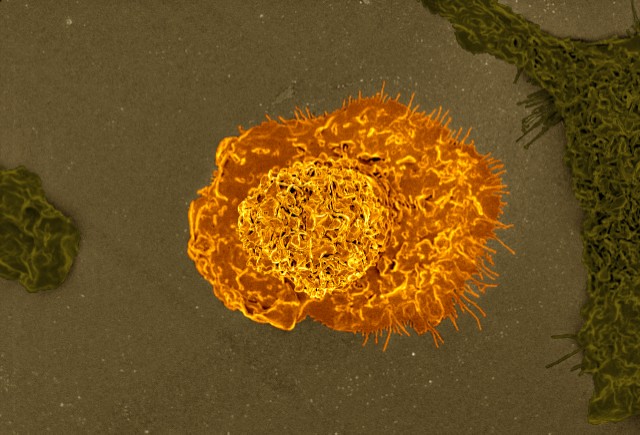
Иммунная клетка-уборщик макрофаг. В задачи макрофага входит поглощать и переваривать всё ненужное и подозрительное, от бактерий до погибших клеток.
При апоптозе прекращается синтез почтит всех белков, кроме особой группы ферментов, называемых каспазами. Они расщепляют клеточные белки, одновременно в клетке расползаются на части органеллы, в том числе и ядро с фрагментированной ДНК, и всё заканчивается тем, что клетка распадается на небольшие кусочки, окружённые мембранами. Эти кусочки поглощают и переваривают иммунные клетки-макрофаги.
Особенность такого клеточного самоубийства в том, что умирающая клетка не раздражает иммунитет. Если бы всё произошло иначе, и клетка просто разорвалась бы, например, от механического напряжения, то иммунитет запустил бы сильное воспаление. При незапланированной смерти из клетки выходит множество молекул, которые в норме должны быть только у неё внутри и нигде больше – например, та же ДНК. Если иммунитет чувствует клеточную ДНК и ряд клеточных молекул вне клетки, он понимает, что что-то очень сильно не в порядке. (Впрочем, стоит уточнить, что и среди программ клеточного суицида есть одна под названием некроптоз, которая так разрушает клетку, чтобы простимулировать иммунную систему.)
При апоптозе же всё совсем не так – умирающие клетки подавляют воспаление и стимулируют ранозаживляющие процессы. Очевидно, апоптотические клетки как-то сигналят поедающим их макрофагам, что всё нормально и звать дополнительные иммунные вооружённые силы не нужно. Именно эти противовоспалительные сигналы от умирающих клеток попытались расшифровать исследователи из Виргинского университета. В статье в Nature они пишут, что клетки в апоптозе действительно выделяют определённые вещества, причём вещества эти оказываются одни и те же вне зависимости от типа умирающей клетки.
Молекулярные сигналы от апоптотических клеток влияют на активность генов в макрофагах. Авторы работы пишут о шести сигнальных молекулах, которые, чтобы нужным образом подействовать на иммунные клетки, должны действовать все вместе, то есть сразу все шесть. И если взять, к примеру, три молекулы-сигнала, то активность генов у макрофагов изменится, но не очень сильно.
Исследователи в своей статье подробно говорят только о трёх сигнальных молекулах – спермидине, гуанозинмонофосфате (ГМФ) и инозинмонофосфате (ИМФ). Спермидин относится к классу полиаминов и образуется в биохимических реакциях, связанных с превращениями аминокислот. Клетки, умирающие апоптозом, усиливают в себе синтез спермидина, который выходит наружу через специальный канал в мембране, образованный белком паннексином 1. Канал открывается ферментами каспазами – теми самыми, которые организуют в клетке апоптоз. То есть умирающая клетка одновременно синтезирует нужный сигнал и создаёт для него канал наружу. (Паннексин 1 выводит из клетки не только спермидин, но и другие апоптотические сигнальные молекулы.) При этом клетки не выпускают из себя мочевину, которая образуется в тех же реакциях, что и спермидин – мочевина как раз стимулирует воспаление, поэтому при апоптозе она никак не должна оказаться снаружи.
Спермидин, ГМФ и ИМФ связаны с множеством молекулярных процессов. ГМФ и ИМФ действуют на рецепторы, которые посылают сигналы целому ряду генов, в том числе и тех, которые связаны с иммунитетом. Известно также, что инозин, который можно получить из ИМФ, очень эффективно подавляет воспаление. Вводя спермидин, ГМФ и ИМФ мышам с артритом, исследователям удавалось ослабить симптомы болезни, которые опять же возникают из-за сильного воспаления; и точно так же с помощью тех же трёх молекул удавалось ослабить иммунное отторжение у мышей с пересаженным лёгким.
Источник: Наука и жизнь

