
Казалось бы, чем наша же собственная ДНК может не угодить нашему иммунитету? Да всем — когда оказывается в цитоплазме. Потому что организму известно: генетический материал хранится внутри органелл, а цитозольная ДНК будет принадлежать бактерии, вирусу, паразиту... кому угодно, но не нам. Следовательно, ее жизненно необходимо распознать и вовремя уничтожить. Для раковых клеток вытекшая в цитоплазму ДНК — дело распространенное. Но последнее, в чем они заинтересованы, — быть замеченными иммунной системой. В этой статье пойдет речь о том, как работает внутриклеточный сенсор cGAS—STING и какую роль он играет в развитии рака.
Немного про иммунитет

Когда чужак проникает на «территорию» нашего организма, у него не так уж много шансов остаться незамеченным. Бактерии и вирусы всячески пытаются спрятаться от иммунитета, но в ходе эволюции иммунная система запоминала наиболее часто встречающиеся патогенные структуры и теперь при встрече с ними умеет распознавать их и сразу бить тревогу. Эти структуры, которые выдают патоген нашей иммунной системе с потрохами, называются патоген-ассоциированными молекулярными образами (pathogen-associated molecular patterns, PAMPs). Для них у иммунных клеток есть специальные рецепторы, такие как Toll-like (TLR) и Nod-like (NLR), после связывания с которыми в ход пускается первая линия неспецифической обороны — врожденный иммунитет. Особенностью врожденного иммунитета является способность реагировать на патоген вне зависимости от того, встречался ли с ним организм до этого или нет. Его задача ослабить врага и помешать его распространению, в то время как нарабатываются основные силы — антитела.
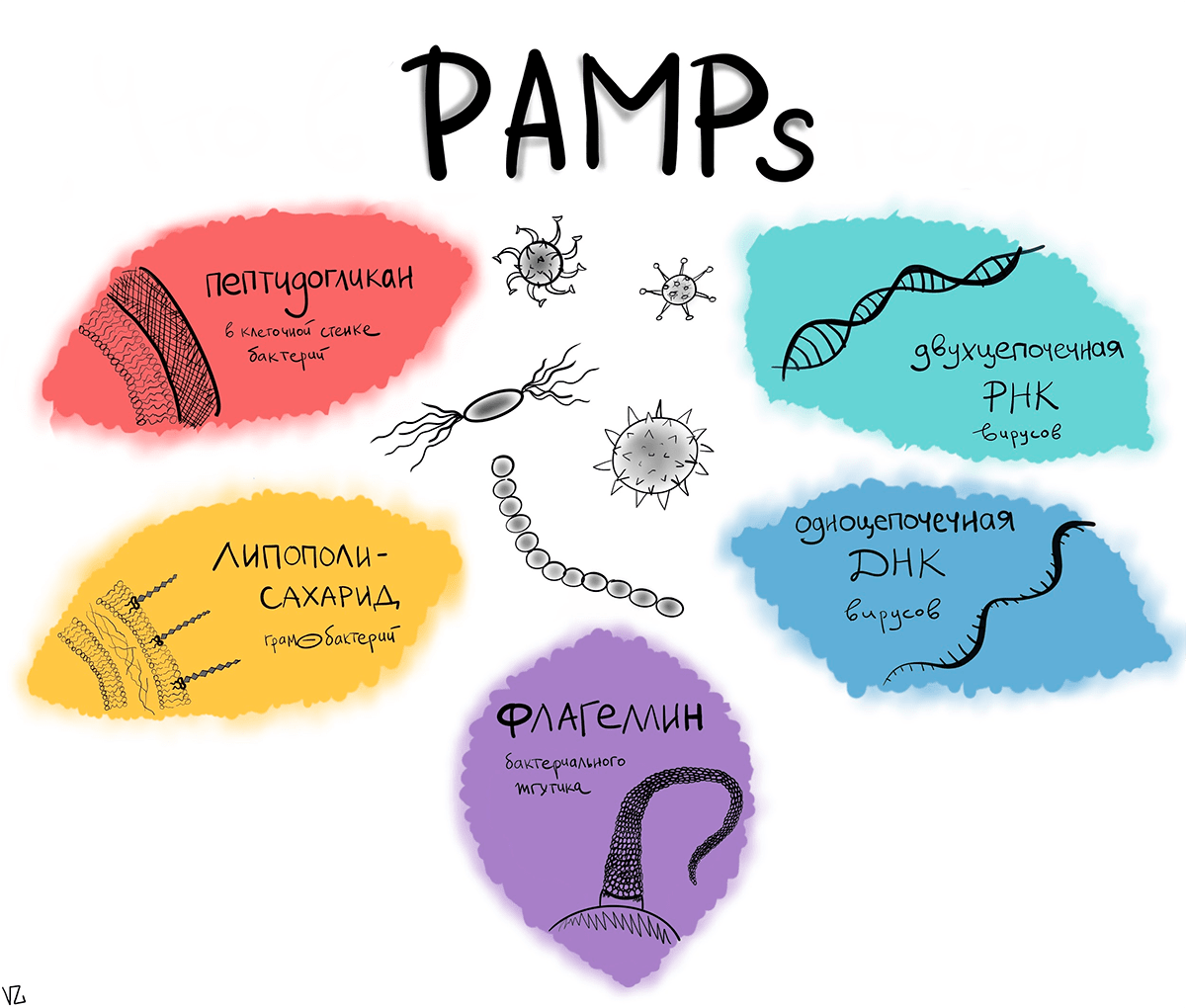
Замкнутый образ жизни ДНК
Однако не только инородные агенты могут провоцировать иммунную реакцию. Наша собственная ДНК может стать причиной для тревоги. В норме генетический материал надежно спрятан в ядре и митохондриях и поводом для его выхода наружу может послужить лишь процесс деления клетки — когда ядерная мембрана разрушается и хромосомы расходятся к клеточным полюсам. За исключением этого события в жизни клетки наша ДНК предпочитает не высовываться из укрытия, и на то у нее есть весомые причины.

Пока ДНК упрятана в своей органелле, ее всячески лелеют и защищают, но как только она вышла наружу — завяли помидоры! Теперь наша же ДНК — цель для ликвидации как нечто аномальное и потенциально опасное. Ведь двухцепочечная ДНК есть не только у нас, но и у бактерий и некоторых вирусов (например, простого вируса герпеса) — тут уж сложно отличить, где чья. Спровоцировать утечку ДНК из прячущей ее органеллы могут различные повреждения клетки, в частности окислительный стресс, но сказать, каким именно образом и почему она периодически выходит наружу даже из здоровой клетки — сложно. На этот случай у клетки есть ферменты, разрушающие двухцепочечную ДНК в цитоплазме до того, как запустится защитная реакция — TREX1 и ДНКаза II.
Например, недостаток TREX1 у человека связан с тяжелыми аутоиммунными заболеваниями (как системная красная волчанка) из-за избыточной продукции интерферона 1 и других провоспалительных цитокинов, а недостаток ДНКазы, лизосомального фермента, вообще несовместим с жизнью эмбриона.
Хрупкий дом забытой хромосомы
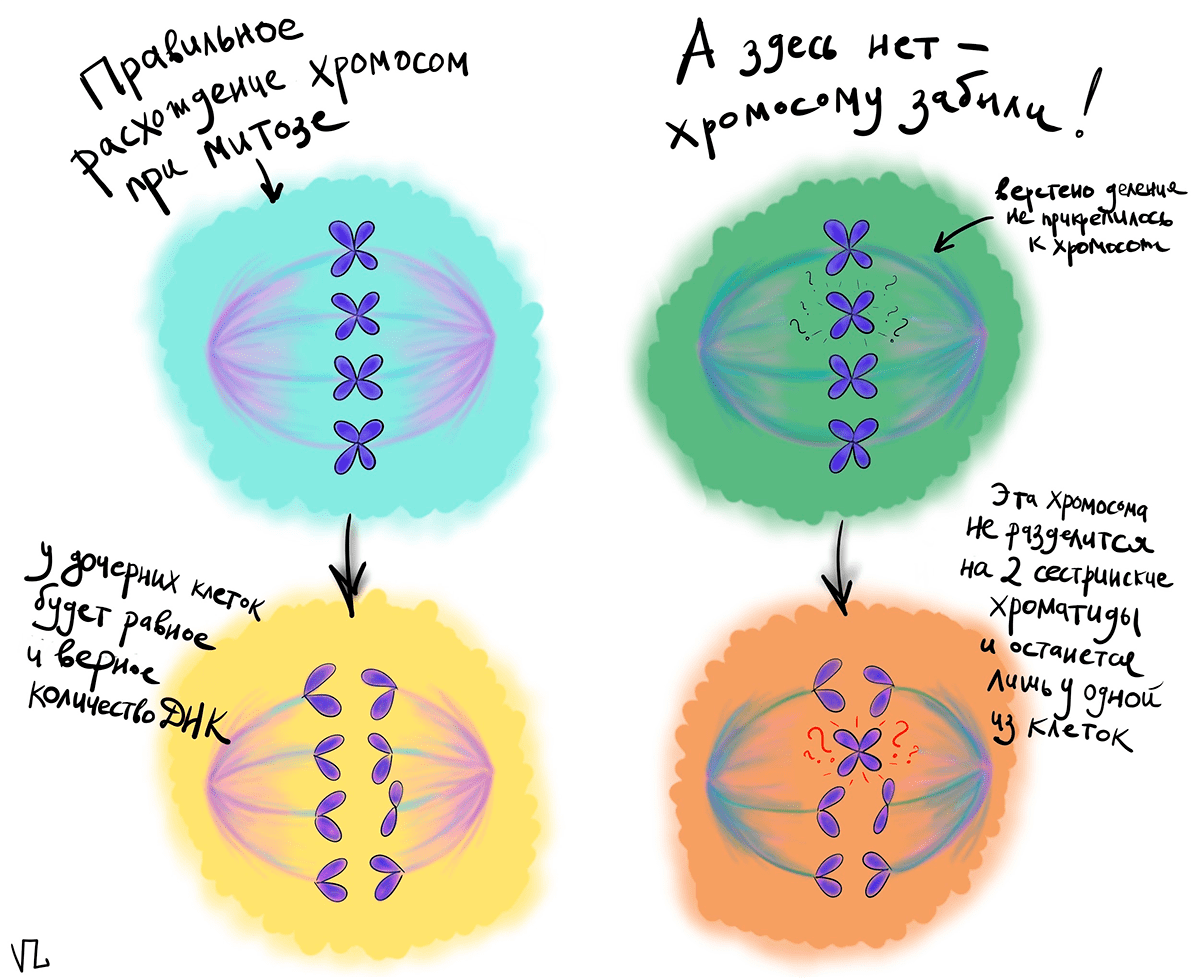
ДНК в цитоплазме часто встречается у раковых клеток. Одной из их ключевых характеристик является генетическая нестабильность, то есть повышенная вероятность появления точечных мутаций и различных хромосомных перестроек. Если мутации затронут гены, ответственные за сборку веретена деления и расхождения хромосом при митозе, то может получиться так, что какую-нибудь хромосому не «прихватят» с собой в полюс клетки, и та останется не у дел. Но долго горевать брошенная хромосома не будет и организует свое собственное, хоть и маленькое, ядро — микроядро. Микроядро может не содержать генов, кодирующих белки ответственные за хромосомную стабильность, тогда такое явление называется хромотрипсис, что приводит к очень масштабным повреждением ДНК, при этом микроядро может в последствии слиться с основным, что в свою очередь может привести к возникновению опухоли. Либо в результате поделившиеся раковые клетки будут иметь неполный набор хромосом, что, очевидно, не способствует поддержанию генетической стабильности, а способствует прогрессированию злокачественности. При этом ДНК в микроядре будет продолжать жить независимой от главного ядра жизнью. В целом, для многих типов раковых клеток свойственно наличие микроядер. Они тоже окружены мембраной, но не такой прочной, как у настоящего ядра. Ее довольно легко продырявить, и тогда ДНК вытекает в цитоплазму. И вот тут мы переходим к главным героям этой статьи.
Стинг и его команда
Как только ДНК, наша или чужеродная, оказывается в цитоплазме, просыпается белок cGAS. У него есть участок из положительно заряженных аминокислот, который взаимодействует с отрицательно заряженным сахарофосфатным остовом ДНК. Это взаимодействие вызывает димеризацию cGAS, и тот начинает превращать ATP и GTP в циклический динуклеотид cGAMP. cGAMP идет к эндоплазматическому ретикулуму, на котором его уже поджидает STING. Но название это возникло не в честь известного музыканта, а как аббревиатура от STimulator of INterferon Genes. STING меняет свою конформацию после взаимодействия с cGAMP и приобретает способность связывается с TBK1, который, в свою очередь, фосфорилирует регуляторный фактор интерферона 3 (IRF3). А он активирует транскрипцию интерферона 1. Здесь наконец-то появился тот, кто будет разбираться с непрошенной ДНК в цитоплазме — интерферон.
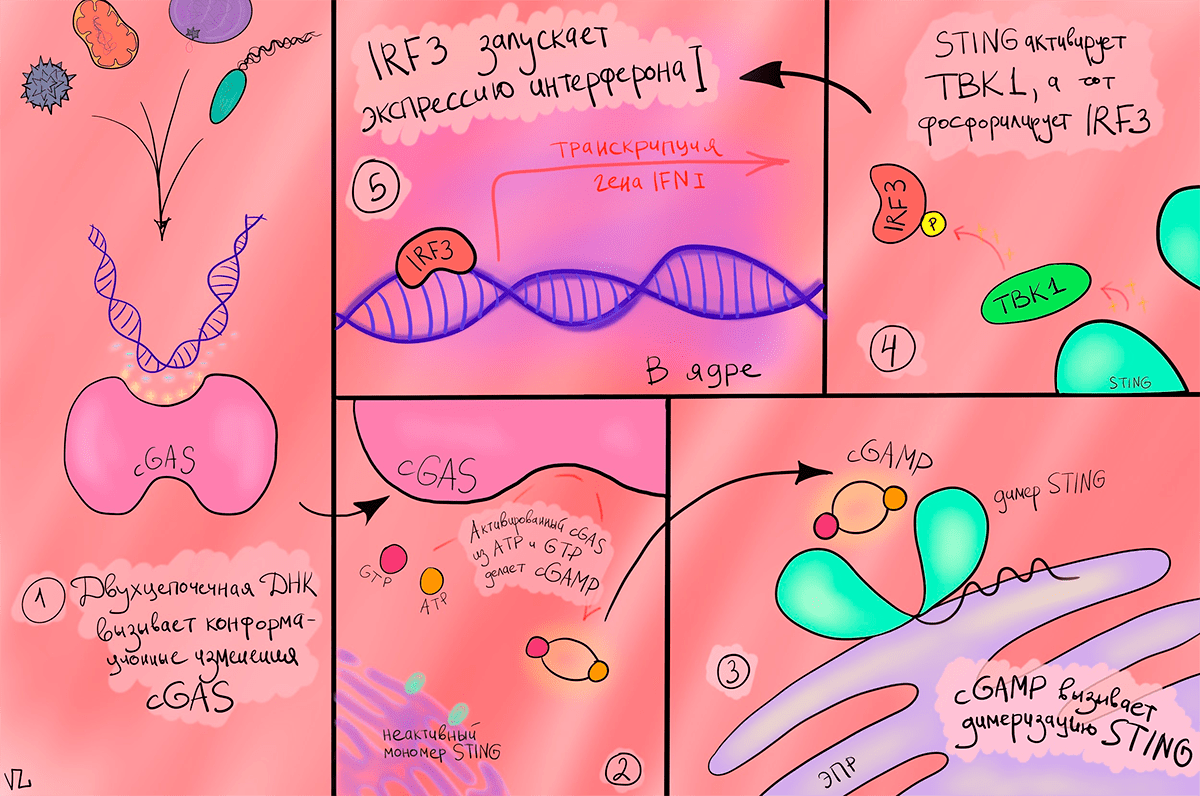
В этом сигнальном пути cGAMP — вторичный мессенджер, то есть переносчик сигнала от одного белка к другому. Но в отличие от классических мессенджеров, как ATP и GTP, этот — циклический. Циклические динуклеотиды охотно используют бактерии, однако у настоящих многоклеточных организмов такое дело не распространено, и в данный момент известен только cGAMP. У cGAMP есть и другая примечательная особенность — он может выходить за пределы клетки, а значит, и распространять сигнал на расстояния.
Снова про иммунитет и еще про интерферон
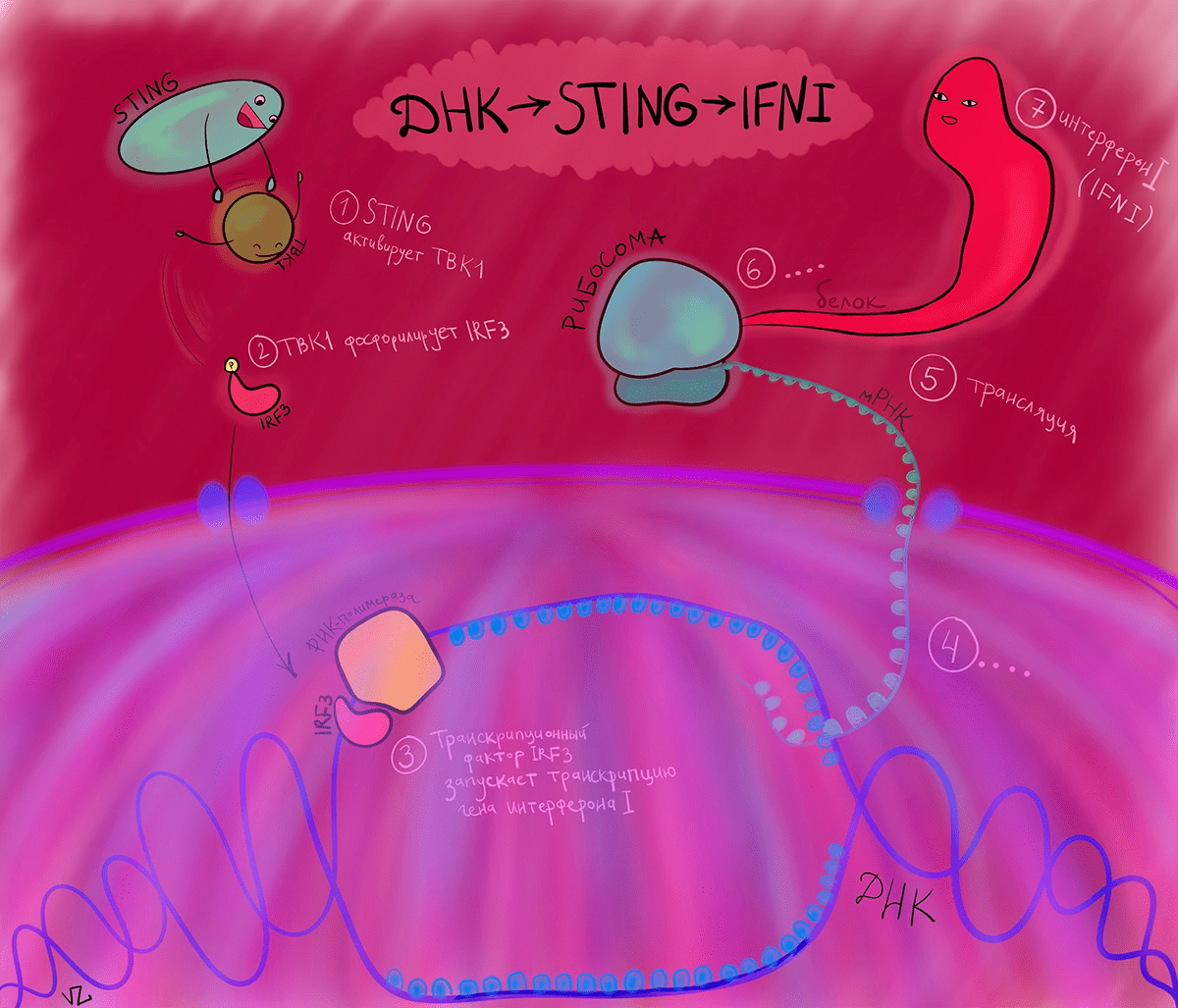
Интерфероны — группа белков, вырабатываемых клетками организма при попадании в него вирусов или бактерий. Основная их задача — предотвратить распространение врага в другие клетки и защитить окружение от уже зараженных клеток. Интерфероны млекопитающих разделяют на два типа, но в контексте cGAS—STING стоит подробнее остановиться на интерфероне 1 типа. Интерферон 1 (IFN1) связывается со своим рецептором IFNAR и запускает каскад, ведущий к активации транскрипции различных генов, которые помогают клеткам бороться с непрошенными гостями.
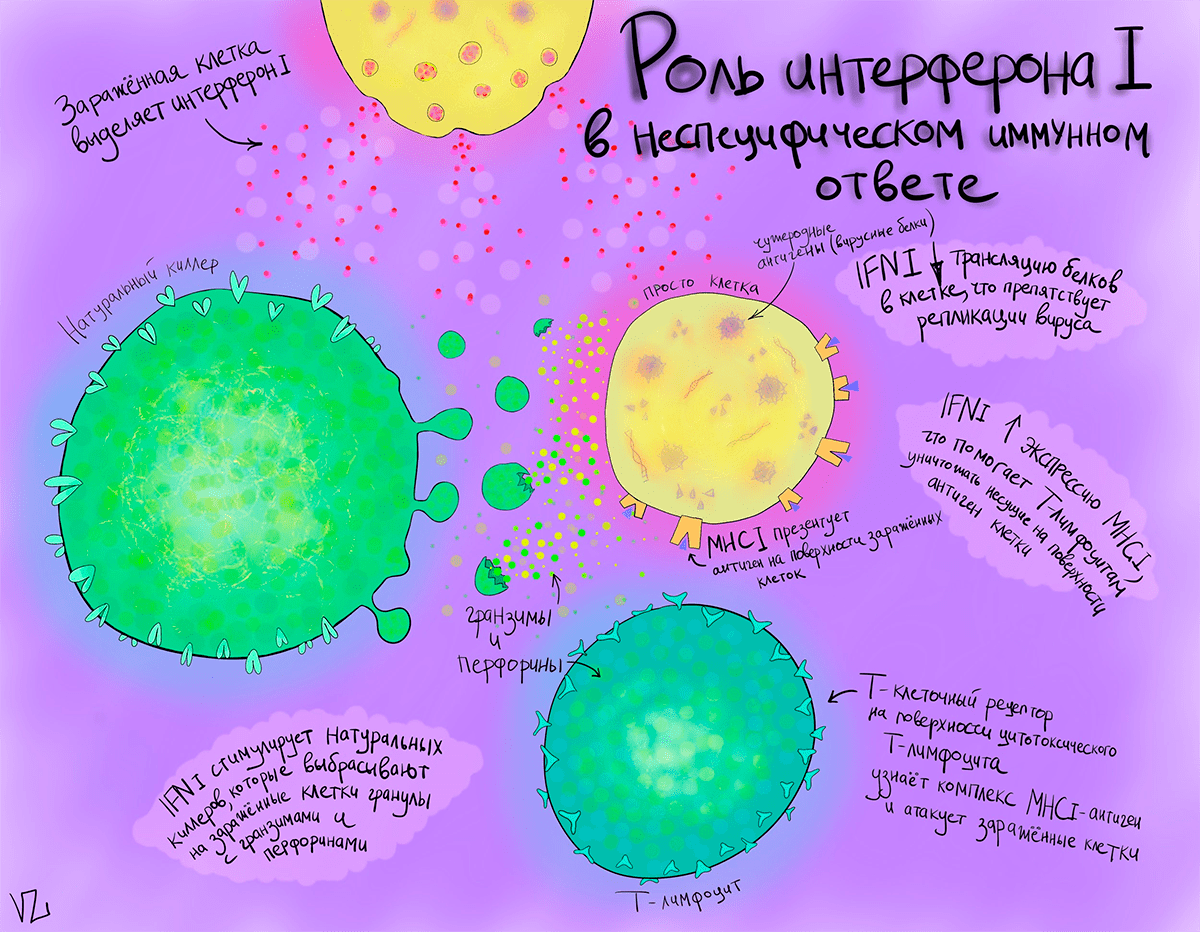
Интерферон активирует транскрипцию группы генов — interferon-stimulated genes (ISGs). Она включает в себя:
- Белок PKR, который фосфорилирует эукариотический инициаторный фактор eIF2α, что ведет к подавлению трансляции многих белков, в том числе тех, которые нужны для репликации вируса.
- IFN-induced protein with tetratricoid repeats (IFIT), снижающий пролиферацию клеток и разрушающий РНК внутри клеток, которые не имеют 5′-кэпа.
- Interferon-induced transmembrane protein (IFITM), который мешает вирусам, окруженным клеточной мембраной в цитоплазме, сливаться с лизосомами и эндосомами, что необходимо им для снятия с себя капсида и высвобождения генетического материала.
- Хемокины CXCL9, CXCL10 и CXCL11, привлекающие лимфоциты к месту инфекции.
- MHC1, количество которого повышается под действием интерферона 1. MHC1 выставляет на поверхности инфицированной клетки частички патогена (например, белок вирусного капсида), что позволяет цитотоксическим Т-лимфоцитам распознавать зараженные клетки и убивать их.
- Натуральные (естественные) киллеры, при узнавании инфицированной клетки выделяющие гранулы, в которых содержатся белки перфорины и гранзимы, формирующие поры в мембране и вызывающие тем самым клеточную смерть.
Интерферон 1 важен в первичной защите, приостанавливая репликацию вируса, чтобы дать организму время наработать более смертоносное оружие — специфические к данному вирусу антитела. А пока антитела производятся, интерферон 1 стимулирует неспецифические защитные силы организма, прямо или косвенно воздействуя на клетки иммунной системы.
Однако стоит отметить, что в борьбе с патогеном интерферон 1 может переходить на сторону противника. При хронической вирусной инфекции (например, ВИЧ) он может провоцировать клеточную смерть Т-лимфоцитов, тем самым сильно ослабляя иммунитет. А при туберкулезе Mycobacterium tuberculosis намеренно выбрасывает ДНК в цитоплазму клетки-хозяина, стимулируя выработку интерферона 1, что предположительно только способствует вирулентности бактерии.
Два лица интерферона 1
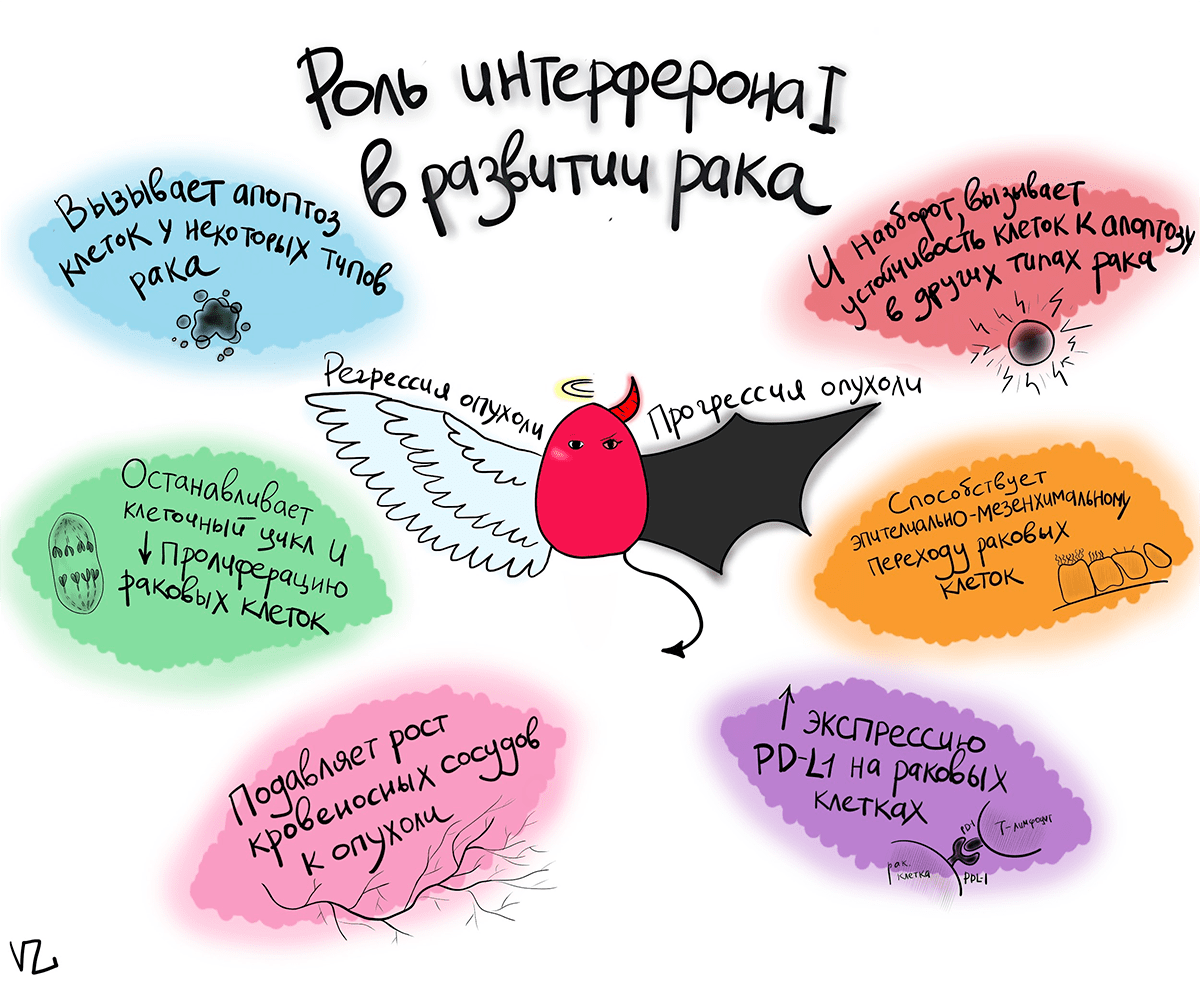
Но помимо воспаления и борьбы с инфекцией, интерферон 1 может влиять на развитие рака. Здесь все становится совсем запутанным. Казалось бы, интерферон 1 играет ключевую роль в неспецифическом иммунитете, и, разумеется, должен быть верным помощником в уничтожении раковых клеток.
Интерферон понижает экспрессию фактора роста эндотелия сосудов (VEGF) и так снижает рост сосудов в область развивающейся опухоли. Это сильно затрудняет ей жизнь, так как ее быстро делящимся клеткам особенно необходимо постоянное поступление кислорода и питательных веществ с кровотоком.
Также интерферон повышает экспрессию ингибиторов циклин-зависимых киназ (p21, p27, p15), которые замедляют переход из одной фазы клеточного цикла в другой, то есть отсрочивают момент, когда клетка подойдет к стадии митоза. В результате раковые клетки начинают медленнее делиться.
Но на самом деле все не так радужно. В зависимости от типа опухоли, ее стадии развития и других факторов, интерферон 1, наоборот, может способствовать ее росту.
Интерферон 1 провоцирует эпителиально-мезенхимальный переход в раковых клетках. Если очень кратко, то это означает, что клетка из зрелого состояния возвращается к состоянию, близкому к стволовому. Крайне нежелательное явление, так как после него опухоль будет склонна к метастазированию.
Интерферон повышает выработку раковыми клетками белков PD-L1, которые ингибируют Т-лимфоциты и не дают им атаковать злокачественные клетки.
Несмотря на неоднозначное влияние интерферона 1 на развитие рака, cGAS—STING-путь является основным сенсором цитозольной ДНК, которая, как уже было сказано выше, служит косвенным признаком генетической нестабильности и хромосомных поломок, а значит — и рака. Предполагается, что cGAS—STING обнаружит вытекшую ДНК и запустит клеточную смерть, опосредованную интерфероном. Но злокачественным клеткам эта идея не по вкусу. Они усыпляют cGAS—STING, чтобы иммунная система их не видела.
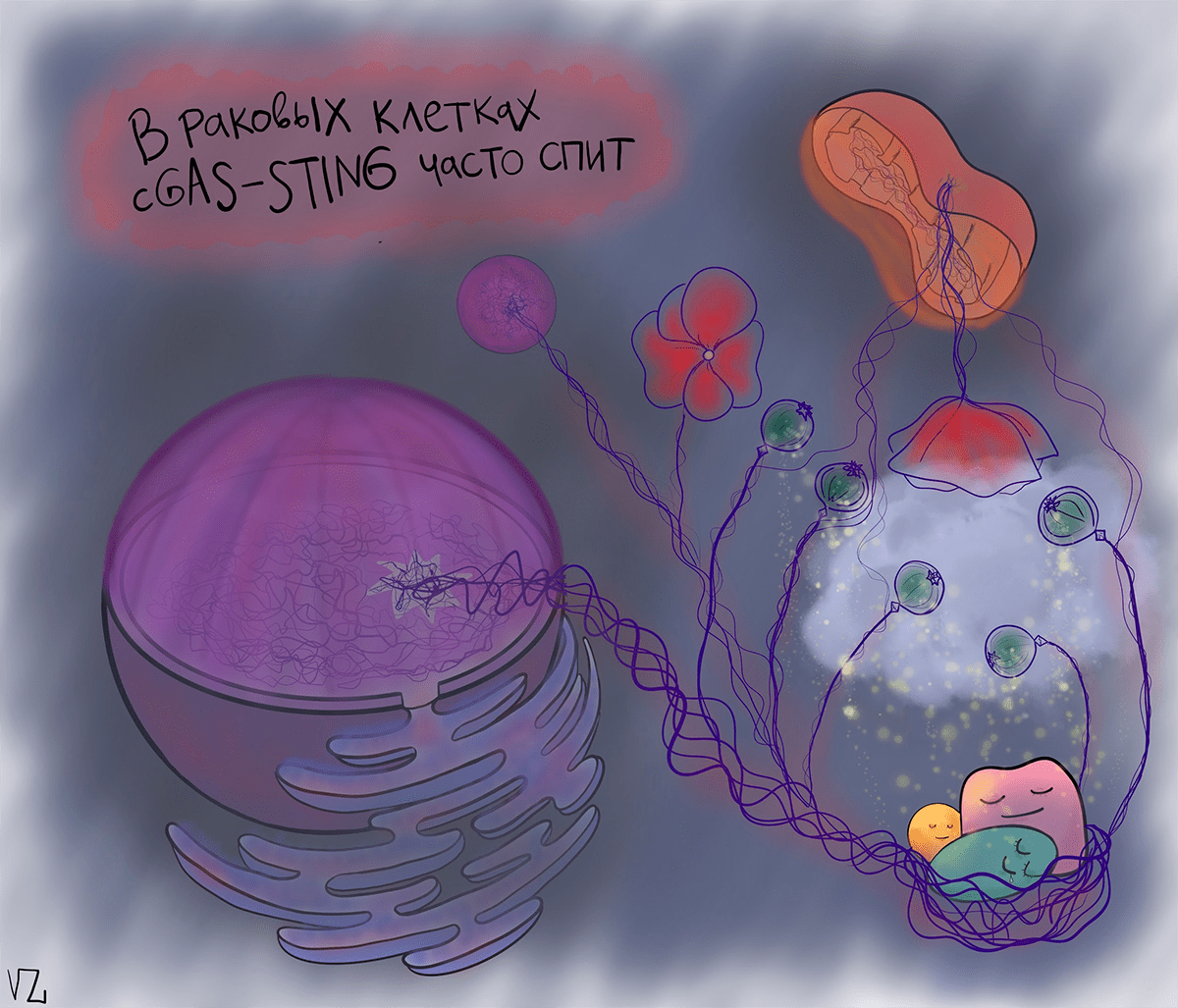
Вывод такой: при борьбе с некоторыми типами рака активировать cGAS—STING — верная идея. Ведь ДНК в цитоплазме может служить еще одной отличительной особенностью злокачественной клетки. Сейчас cGAS-STING активно изучается, и до клинических испытаний его активаторов дело еще не дошло, но полагают, что в комбинации с иммунотерапией это может быть новым перспективным шагом в терапии рака — наш иммунитет сам сможет распознавать и специфически атаковать раковые клетки, как бы те ни старались себя спрятать.
Источник: БИОМОЛЕКУЛА

