Соединения со связью азот—азот сравнительно редки и не ассоциируются с живой природой. Скорее, можно вспомнить про мутагенный эффект азокрасителей и токсичность гидразинов. И тем не менее в обзоре представлено более двухсот соединений с N—N связью, продуцируемых живыми организмами (авторы еще забыли добавить в список простейший молекулярный азот N≡N!). А ведь весь этот скрупулезно собранный материал — капля в море полного многообразия природных молекул!
Мы привыкли интуитивно подразделять химические вещества на природные и не встречающиеся в природе. Конечно, с самого начала было известно, что эта классификация условная. И тем не менее она прочно вошла в наши представления. Поэтому даже от людей с учеными степенями нередко можно услышать фразы вроде «Биодеструкция фенола в природе невозможна». Данная статья ставит задачу показать читателю возможности живых организмов по синтезу и накоплению веществ, традиционно рассматриваемых в качестве «не встречающихся в природе». Немного касается она и биодеструкции некоторых таких соединений. А основной вывод в том, что под давлением фактов представления о природных веществах рано или поздно будут пересматриваться.
Яркое впечатление
Вспоминаю, как лет десять назад мне попалась на глаза статья в Journal of Natural Products, и сразу привлекла внимание. Ее авторы изучали химический состав произрастающего в Малайзии гигантского тростника Arundo donax L. из семейства злаковых (Poaceae). Эта трава высотой до шести метров (рис. 1) представляется лакомым кусочком всевозможным травоядным, поэтому выделяет антифиданты — вещества с неприятным вкусом, защищающие от поедания. И среди них — очень необычный метаболит N-4′-бромфенилдифенилацетамид (амид п-броманилина и дифенилуксусной кислоты) (рис. 1). Меня, профессионального биохимика, просто заворожило то, насколько это соединение отличается от привычных природных веществ, встречающихся на страницах учебников биохимии. Вероятно, заворожило оно и авторов, раз они посвятили его обнаружению статью. При всей непохожести пресловутого антифиданта на классические биологические молекулы, он имеет большое структурное сходство с некоторыми неприродными, синтетическими соединениями. Например, гербицид пропанил представляет собой амид 3,4-дихлоранилина и пропионовой кислоты. Известным производным 4-хлоранилина является широко известный антимикробный препарат хлоргексидин (рис. 2).

Рисунок 1. Тростник гигантский и пространственная структура N-4′-бромфенилдифенилацетамида (справа вверху)
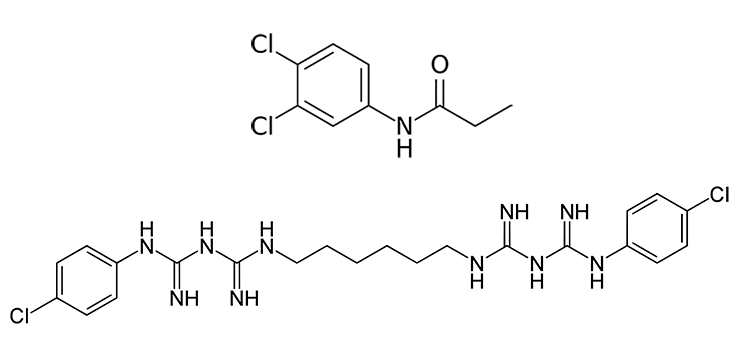
Рисунок 2. Примеры искусственных производных галогенированных анилинов. Вверху: структура гербицида пропанила. Внизу: хлоргексидин.
Эта статья стала одной из первых, которые пробудили у меня интерес к поиску информации о природных молекулах экстраординарных структур и свойств, в первую очередь, являющихся аналогами широко известных искусственных соединений. В то время начались мои работы по биодеградации белого фосфора, вызывавшие у химиков сильнейший скепсис (биологи, кстати, восприняли их более благожелательно: им-то возможности живых систем известны больше!). То есть во многом этот поиск был стремлением доказать скептикам, и в первую очередь самому себе, что живые организмы способны справляться с практически любой задачей по химии.
За десять лет было собрано немало интересных примеров того, как они справляются с этими задачами. И некоторые наиболее показательные, оставившие наиболее яркое впечатление, я стараюсь привести в своих статьях. Безусловно, эта задача увлекает многих авторов. На тему многообразия природной химии есть немало обзоров, как огромных, стремящихся охватить большинство природных веществ, так и лаконичных, посвященных фундаментальным основам ферментативных реакций.
Тяга к металлу
Палочник, защищающегося от хищников, выбрызгивая в них ядовитую жидкость, содержащую хинолин. Надо сказать, что производные хинолина широко распространены в природе. Человек в своей практике тоже их использует. Одним из самых известных производных хинолина является 8-гидроксихинолин (8-оксихинолин) — сильный комплексообразователь (рис. 3).

Рисунок 3. Василек раскидистый и 8-гидроксихинолин (слева вверху)
Строение молекулы этого соединения имеет одну особенность. Гидроксильная группа и атом азота в составе гетероцикла расположены таким образом, что образуют своего рода «клешню», захватывающую и крепко удерживающую ионы металлов. В результате, 8-оксихинолин образует комплексы более чем с сорока (!) элементами Периодической таблицы. Химики используют это свойство для разделения смесей солей металлов, выделения их в чистом виде. А поскольку многие комплексы 8-оксихинолина окрашены, его используют для обнаружения и количественного определения металлов (магния, кадмия, алюминия, цинка) в растворах фотоколориметрическими методами. Комплексообразование с органическими лигандами — единственный способ растворять соли металлов в органических растворителях, таких как хлороформ. И здесь оксихинолин оказывается полезным. Кроме того, комплексы 8-оксихинолина обладают люминесцентными свойствами, на их основе получают даже органические светодиоды. Но самая старая сфера применения этого комплексообразователя — медицина. 8-оксихинолин оказался эффективным противомикробным препаратом, в том числе противогрибковым. Безусловно, этот эффект тоже напрямую связан со способностью хелатировать металлы. Микробам для жизнедеятельности нужно множество микроэлементов, а оксихинолин переводит их все в биологически недоступную форму. При этом оксихинолин связывает ионы металлов настолько активно, что его не использовали для дезинфекции металлических поверхностей — он с ними реагировал! Еще недавно он использовался в качестве антимикробного препарата. Теперь же его вытеснили более эффективные соединения.
Я был удивлен, когда прочитал, что 8-гидроксихинолин является природным веществом растительного происхождения. Он выделяется в почву корневой системой василька раскидистого Centaurea diffusa Lam. — травянистого растения, произрастающего в полупустынях и служащего пищей верблюдам (рис. 3). Проявляет при этом фитотоксическое действие — подавляет рост растений-конкурентов, лишая их необходимого набора микроэлементов. Конечно, разнообразие хинолиновых алкалоидов в природе (особенно в растениях) совсем немалое. Самым знаменитым их представителем является хинин из коры хинного дерева, которым лечат малярию . Собственно, хинин и подарил название всей этой группе веществ. И тем не менее удивительно обнаружить в природе вещество, которое уже долгое время служит человеку.
Краеугольный камень
Ацетилен (этин) — С2Н2 (рис. 4, слева вверху) — является одним из самых известных химических веществ и крупнотоннажным промышленным продуктом. Этот горючий газ можно получать разными способами. Самый известный — реакция карбида кальция с водой. При контакте с водой СаС2 моментально гидролизуется с выделением ацетилена и гидроксида кальция. Вода, как намного более сильная кислота, вытесняет ацетилен из его соли. Сам карбид кальция получают, спекая без доступа воздуха негашеную известь — оксид кальция — с коксом. Неприятный «запах карбида», ассоциирующийся с ацетиленом и сварочными работами, на самом деле является запахом фосфина. Оксид кальция содержит примеси фосфатов и сульфатов, и образующийся карбид всегда содержит сульфид и фосфид кальция, которые гидролизуются вместе с ним до сероводорода и фосфина. Химически чистый ацетилен не имеет запаха. Другой распространенный метод получения ацетилена — пиролиз метана или природного газа.
Ацетилен — горючий газ. Горит ярким белым пламенем, а в атмосфере чистого кислорода пламя становится очень горячим, свыше 2600 °С. Поэтому, ацетилен чаще, чем другие газы, используется в газовой сварке (рис. 4).

Рисунок 4. Одно из направлений применения ацетилена — газовая сварка. Слева вверху — ацетилен.
Но сварка — далеко не единственное применение ацетилена. Это вещество химически активно, склонно к полимеризации и реакциям присоединения. Разнообразие химических превращений обусловлено наличием в молекуле ацетилена сравнительно редко встречающейся тройной связи между атомами углерода. Ацетилен может служить сырьем для производства практически всех классов органических соединений, и в странах, не имеющих запасов природного газа и нефти, является ценным стратегическим сырьем. Достаточно вспомнить школьный курс органической химии, чтобы понять, какой широкий спектр веществ можно производить из ацетилена — бензол и нафталин, винилхлорид, винилацетат, этилен, 1,2-дихлорэтилен, уксусный альдегид, пиридин, пиррол, бутадиен, акрилонитрил и акрилаты, электропроводящий полимер полиацетилен, элементоорганические соединения (например боевое отравляющее вещество люизит), ацетилениды металлов, и это далеко не полный список!
Интересно, что ацетилен выявили и среди метаболитов метилхлороформа (рис. 5а). Все алкилгалогениды являются ядами, поражающими печень — гепатотоксинами. И когда они попадают в печень, их яростно атакуют ферменты, такие как цитохром Р450, защищающий организм от многочисленных ядов, участвующий в биотрансформации многих лекарств. В организме млекопитающих метилхлороформ с участием цитохрома Р450 претерпевает сложные превращения с образованием свободных радикалов, и одним из продуктов становится С2Н2. В свою очередь, сам метилхлороформ (1,1,1-трихлорэтан) вырабатывается некоторыми красными водорослями, например, произрастающими у берегов тропической Азии и Филиппин Eucheuma denticulatum, известным источником студнеобразователя каррагинана (рис. 5б). Таким образом, и ацетилен с большой долей условности можно считать биологической молекулой.
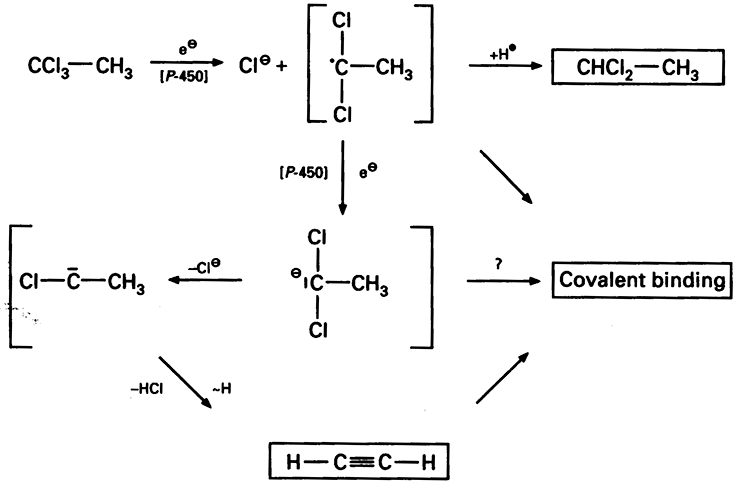
Рисунок 5а. В организме млекопитающих метилхлороформ превращается в ацетилен

Рисунок 5б. Водоросли Eucheuma denticulatum
Любопытно, но есть микроорганизмы, способные питаться ацетиленом! Метилотрофные микробы задолго до человека освоили реакцию Бутлерова. Так вот, специализированная морская бактерия Pelobacter acetylenicus проводит другую именную реакцию — реакцию Кучерова. Она гидратирует ацетилен до ацетальдегида, который далее окисляется до уксусной кислоты либо восстанавливается в этанол. Причем, если химики ведут гидратацию алкинов (простейшим представителем которых является ацетилен) в присутствии сильно ядовитых солей ртути, то бактерия использует более продвинутый катализатор. Фермент ацетиленгидратаза (рис. 6) содержит в активном центре атом вольфрама, который намного менее ядовит.
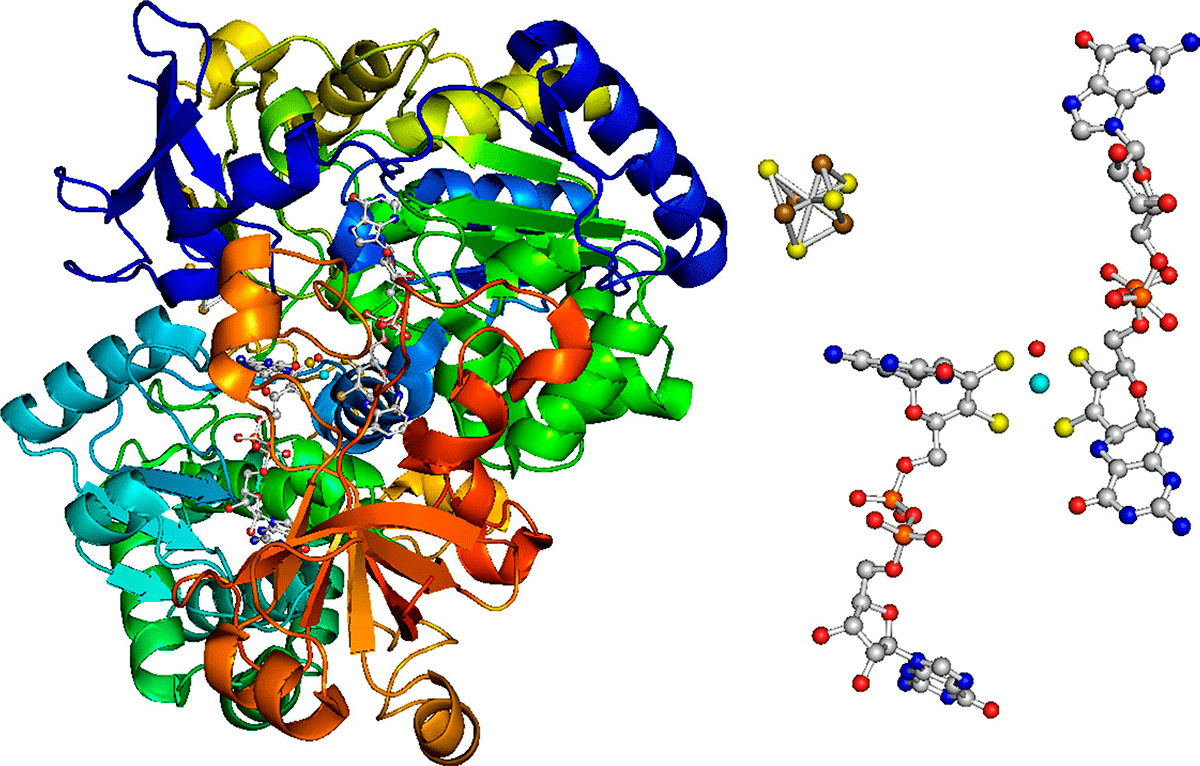
Рисунок 6. Фермент ацетиленгидратаза
То есть живые организмы могут как продуцировать ацетилен, так и потреблять его!
Цианофосфонат из экологически чистого источника
Диизопропилфторфосфат — первое фосфорсодержащее боевое отравляющее вещество, а ныне — препарат, широко применяемый в исследованиях по физиологии и медицине. Из военных арсеналов его быстро вытеснили еще более токсичные гомологи — табун (рис. 7, внизу), зарин, зоман, циклозарин, GV. Еще позже, уже в послевоенное время, им на смену пришли американский VX и советские Р-33 и А-232. В отличие от диизопропилфторфосфата, все они — истинные фосфорорганические соединения, содержащие связи углерод—фосфор. В январе 1937 года в немецком городе Леверкузен при работе с табуном произошел несчастный случай: емкость с веществом оказалась неплотно закрытой, и капля табуна упала на лабораторный стол. В лаборатории находились доктор Герхард Шрадер — «отец» химии фосфорсодержащих ядов, — и его лаборант. В течение нескольких минут после разлива у обоих появились миоз, головокружение и спёртость дыхания. На выздоровление у них ушло три недели! Следует напомнить о том, что табун (этиловый эфир диметиламида цианофосфорной кислоты) — ранний представитель фосфорорганических БОВ и наименее токсичный из них. Открытый Шрадером позже зарин (изопропиловый эфир метилфторфосфоновой кислоты), например, токсичнее на порядок! Однако, Вторая Мировая война по своему характеру отличалась от Первой. В ней не было бесконечных позиционных боев, и химическое оружие, которого накануне войны успели наделать немало (рис. 7), к счастью, почти не применялось.

Рисунок 7. Венгерский солдат в противогазе, 1939 г. Внизу — структурная формула табуна (этилового эфира диметиламида цианофосфорной кислоты).
Казалось бы, в природе подобные вещества просто не могут встречаться! Но действительность имеет обыкновение превосходить ожидания.
До 1959 года предполагалось, что фосфорорганические соединения как класс не существуют в природе. Открытие первого природного фосфоната стало сенсацией. И в настоящее время фосфорорганические вещества биологического происхождения считаются раритетами, хотя описано достаточное их количество. И вот выяснилось, что актиномицет Streptomyces regensis WC-3744 выделяет метаболит уникального строения — цианогидроксиметилфосфоновую кислоту. Это первый известный природный фосфорорганический циангидрин (рис. 8, слева вверху). Вещество, еще полвека назад считавшееся невозможным в живой природе. Действительно, такая простая по структуре молекула содержит сразу две экзотические для природного вещества группы — фосфонатную и цианидную. Это придает ему отдаленное структурное сходство с боевым отравляющим веществом табуном. Известно, что с точки зрения биохимии, микроорганизмы намного совершеннее нас с вами. А стрептомицеты в данном направлении, пожалуй, превосходят остальные формы жизни. Эти живые фабрики являются источником антибиотиков почти всех классов, уникальных ферментов, препаратов для защиты растений — невозможно перечислить весь спектр производимых ими полезных продуктов. Вероятно, цианогидроксиметилфосфоновая кислота (получившая впоследствии более лаконичное тривиальное название «гидроксицианофос») тоже выполняет функцию антибиотика — впрочем, это покажут будущие исследования.
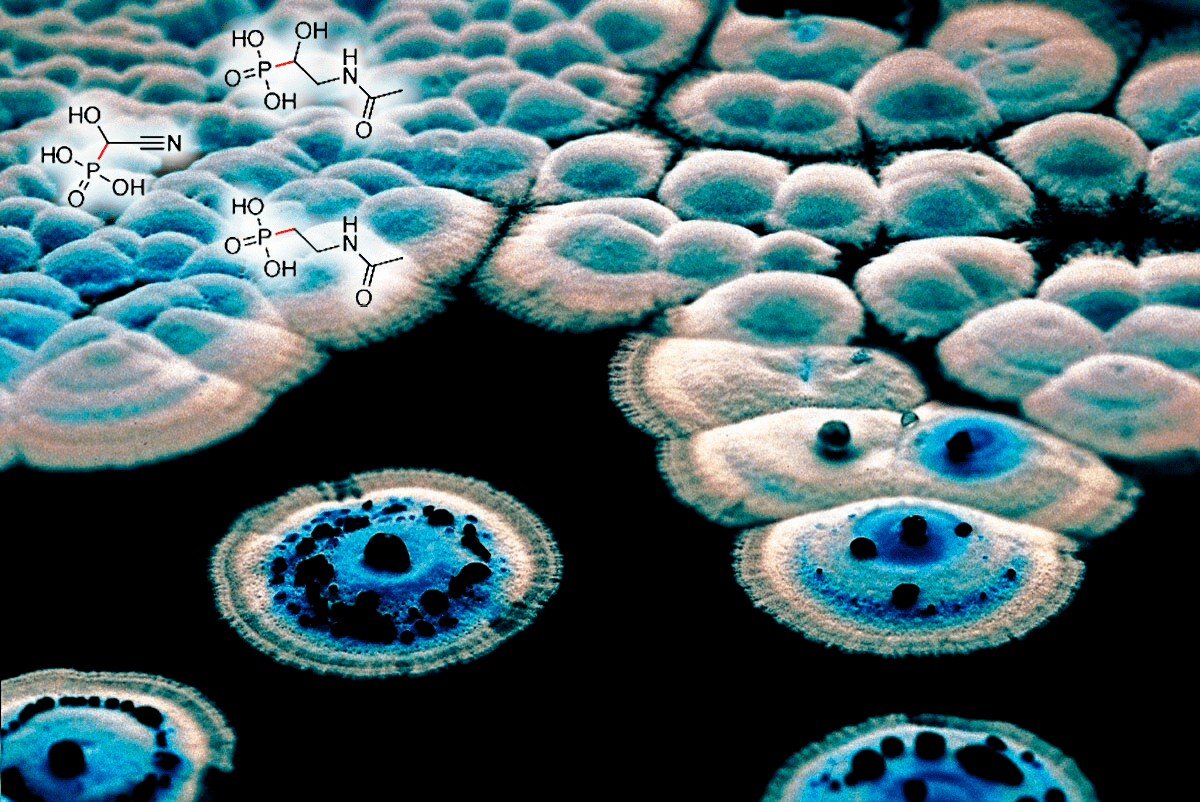
Рисунок 8. Колонии стрептомицетов. Вверху: стрептомицет Streptomyces regensis WC-3744 мастер по производству редких в природе фосфорорганических веществ. Одно из них даже оказалось циангидрином.
Польза от зловония
Губка Ircinia felix, произрастающая в Карибском море (рис. 9), известна отвратительным чесночным запахом. За это местные жители называют ее губкой-вонючкой (stinker sponge). Разумеется, аромат носит защитную функцию: отпугивает хищников или подавляет рост возможных конкурентов. А специфический характер запаха намекает на присутствие летучих сернистых соединений. В растениях из семейства крестоцветных — всем хорошо известных горчице, хрене, васаби и редьке, — содержатся глюкозинолаты, такие как синигрин. При повреждении тканей (например, во время приготовления салата) они реагируют с ферментом мирозиназой и распадаются с образованием аллилизотиоцианата. Это сравнительно летучее вещество и обусловливает характерный запах горчицы.

Рисунок 9. Морская губка Ircinia felix — продуцент метилизонитрила и метилизотиоцианата
Разумеется, губка ирциния состоит с растениями в весьма отдаленном родстве, и свою химическую защиту изобретала независимо от них. В состав ее пахучих компонентов тоже входит изотиоцианат, но другой. Это метилизотиоцианат, известный фумигант. Изотиоцианаты являются аналогами изоцианатов, но атом кислорода в цианатной группе у них замещен атомом серы. Метилизотиоцианатом обрабатывают почву для борьбы с нематодами, фитопатогенными, грибками, сорными растениями (рис. 10а). То есть этот дурно пахнущий яд обладает широким спектром действия и мало избирателен. Вот, оказывается, он есть и в природе. Но метилизотиоцианат, хотя и необычен в роли природного вещества, все же не представляется чем-то экстраординарным.
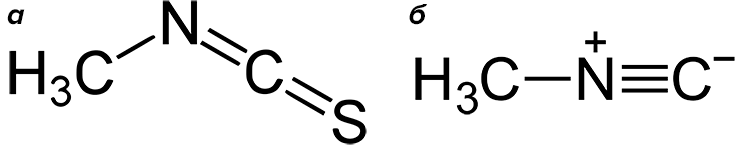
Рисунок 10. Метилизотиоцианат (а) и метилизонитрил (б)
Но в состав пахучего секрета ирцинии входит не только он. Неожиданностью стало обнаружение в нем обладающего отвратительным запахом метилизонитрила (рис. 10б). Изонитрилы (изоцианиды, карбиламины) — класс веществ, изомерных нитрилам (органическим производным синильной кислоты). В состав изонитрильной группы тоже входят углерод и азот, но она «перевернута» — соединена с органической молекулой атомом азота, а не углерода, как в менее экзотических нитрилах. А углерод в составе изонитрильной группы двухвалентен, как в угарном газе. Фактически, изонитрилы — это угарный газ, в котором кислород замещен на амин. И это неспроста. Образование изонитрилов является качественной реакцией на присутствие первичных аминов. Если требуется узнать, присутствуют ли в образце амины, надо провести изонитрильную пробу: добавить хлороформ и спиртовый раствор едкого калия и нагреть. Пройдет реакция:
R–NH2 + CHCl3 + 3KOH → R–N=C↑ + 3KCl + 3H2O
Казалось бы, зачем такие сложности? Ведь амины и сами пахнут, их запах напоминает запах аммиака или рыбы. Но сила аромата аминов не идет ни в какое сравнение с резким зловонием изонитрилов. То есть изонитрильная проба позволяет обнаруживать амины в таких ничтожных концентрациях, когда их собственный запах уловить невозможно. Запах летучих низших изонитрилов, таких как метилизонитрил, описывают как тошнотворный. Мало того, структурное сходство с угарным газом делает их такими же ядовитыми. Поэтому, героиня нашего повествования — губка-вонючка — находится под надежной защитой.
Конечно, она не единственная, кто вырабатывает вещества с изонитрильной группой. В ветеринарии давно используется антибиотик ксантоциллин, тоже содержащий изоцианидные группы и вырабатываемый грибками пенициллами. Но в целом изонитрилы довольно редки в природе, и обнаружение каждого такого природного вещества становится резонансным.
Вредная привычка
Синтетические полимеры настолько прочно вошли в наш быт, что мы не представляем жизни без них. Из них делают буквально все — от изоляции на высоковольтных проводах до элегантной одежды и теплых пледов. Разумеется, свойства каждого конкретного полимера определяются свойствами исходного мономера, из которого он получен. Для того чтобы связать плед, годится искусственная шерсть, которая, скорее всего, представляет собой полиакрилонитрил. Выговорить такое слово непросто, поэтому обычно этот полимер называют не химическим названием, а торговыми — в бывшем Советском Союзе популярно обозначение «нитрон» (рис. 11). Из чистого полимера акрилонитрила вяжут мягкие ткани. Из сополимера с винилхлоридом получается более жесткая ткань, из которой ткут ковры. Сложный полимер акрилонитрила, дивинила и стирола (АБС-пластик) является ударопрочной пластмассой, из которой изготавливают пластиковые контейнеры и корпуса телефонов.

Рисунок 11. Из волокна нитрона получают искусственную шерсть. Справа внизу — акрилонитрил.
Надо сказать, что при всей безобидности синтетических полимеров (серьезную опасность они представляют, только если загорятся), мономеры, из которых их синтезируют, являются очень токсичными веществами. Оно и понятно. Чтобы вещество могло полимеризоваться, его молекулы должны содержать кратные связи — двойные, реже тройные. Они резко усиливают реакционную способность молекулы, в особенности к реакциям присоединения. Собственно, молекулам акрилонитрила (рис. 11, справа внизу) или винилхлорида все равно, к чему присоединиться — к точно такой же молекуле или, например, азотистому основанию ДНК. В результате, оба вещества являются сильными мутагенами и канцерогенами.
Впрочем, канцерогены есть и среди природных веществ. Например, установлено такое действие для ареколина (рис. 12, справа внизу) и гуваколина — психотропных алкалоидов бетелевой пальмы (рис. 12) и компонентов очень популярного в Индии и Юго-Восточной Азии тонизирующего средства бетель. В странах Востока жевание бетеля (смеси плодов арековой пальмы, листьев местного перца и, иногда, табака) замещает распространенное на Западе табакокурение. По статистике, рак ротовой полости встречается очень часто в регионах, где популярно жевание бетеля. На Тайване 85% случаев рака ротовой полости наблюдается именно среди заядлых потребителей этого легкого наркотика.

Рисунок 12. Бетелевая пальма Areca catechu и ареколин (справа внизу) — одно из действующих начал бетеля
Было замечено, что акрилонитрил и гуваколин образуют с ДНК практически идентичные аддукты (продукты присоединения молекул), содержащие характерные β-цианоэтильные группы. Из этого был сделан смелый, но вполне обоснованный вывод, что акрилонитрил в качестве короткоживущего промежуточного вещества образуется в процессе метаболизма алкалоидов Areca catechu. Если вывод соответствует действительности, то этот важный полупродукт химической промышленности тоже можно назвать природным соединением!
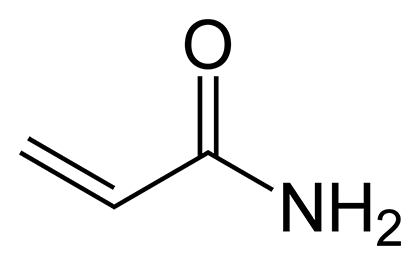
Рисунок 13. Акриламид
Акриламид (рис. 13) по строению и свойствам близок к акрилонитрилу и представляет собой продукт его неполного гидролиза. Тоже является промышленным продуктом. Полимеры акриламида — полиакриламиды, гидрофильные полимеры, отлично набухают в воде и образуют знаменитые гели. Полиакриламидные гели находят широкое применение — от разделения смесей белков гель-электрофорезом до осаждения хлопьев активного ила на очистных сооружениях и удержания влаги в почвах аридных зон. Мономерный акриламид, так же как акрилонитрил, является канцерогеном. Известно, что он образуется при термическом разложении аминокислоты аспарагина и может накапливаться в продуктах питания при жарке. Акриламид — одна из причин вреда для здоровья жареной пищи, например, чипсов. Но нас-то в первую очередь интересует вопрос, является ли акриламид природным веществом?
Известно, что бактерии, занимающиеся биодеградацией акрилонитрила, воздействуют на него ферментом нитрилазой и гидролизуют до акриламида. Но этот факт еще не доказывает «природный статус» акриламида: в конце концов, исходное вещество все-таки произведено на предприятии. И вот исследования показали, что аспарагин может превращаться в акриламид не только при термическом воздействии, но и при температуре человеческого тела, если на него действовать перекисью водорода. А Н2О2 тоже является метаболитом, образуется в организме при окислительном стрессе. Стало быть, оксидативный стресс, помимо множества других угроз, опасен еще и выработкой акриламида прямо в клетках нашего тела!
И, вдобавок, я был весьма удивлен, прочитав о том, что молекулы с винильной группой можно полимеризовать при помощи ферментов. Например, акриламид при помощи лакказы может быть полимеризован в полиакриламид. Конечно, язык не повернется назвать полиакриламид природным соединением. И тем не менее важно знать, что это вещество можно получить из биологического предшественника (аспарагина) при помощи биологических катализаторов — ферментов. Этот пример в очередной раз демонстрирует отсутствие сколь-нибудь четкой грани между природной и «неприродной» химией.
Отрава? Нет, метаболит
Ацетон, пожалуй, является одним из самых широко известных химических веществ. Будучи по природе простейшим кетоном, он широко применяется в качестве растворителя лаков, красок, жиров, экстрактов из растений, в том числе и в быту. Ацетон — крупнотоннажный и дешевый продукт химической промышленности. Работая с этим растворителем, следует помнить о том, что он огнеопасен и ядовит. Будучи летучей жидкостью, ацетон быстро испаряется, а его пары оказывают выраженное токсическое действие, в частности, поражают печень, почки и нервную систему. Лет двадцать пять — тридцать назад в подростковой среде было распространено печально известное явление — токсикомания. Вдыхание паров ацетона вызывало опьянение и эйфорию, но являлось чрезвычайно вредным для здоровья и рискованным для жизни.
Однако ацетон — не только растворитель. Это сырье в производстве полиметилметакрилата (органического стекла), антисептика йодоформа. С перекисью водорода ацетон реагирует с образованием перекиси ацетона — сильной и очень опасной в обращении взрывчатки. А галогенированием можно получать бромацетон и йодацетон — вещества с раздражающим, слезоточивым действием. Широкое распространение и применение ацетона привело к тому, что в массовом сознании он, наряду с некоторыми нефтепродуктами, является своего рода символом «химической отравы».
Но так ли это? Большинство людей, далеких от химии и естественных наук вообще, сильно удивляются, когда узнают, что ацетон — природное вещество. Главным его продуцентом в природе является анаэробная бактерия Clostridium acetobutylicum, сбраживающая сахара в ацетон и бутиловый спирт. Незначительные количества ацетона в промышленности получаются при помощи этих бактерий, хотя бóльшая его часть все-таки производится из природного газа и нефти. Ацетон также выделяется как побочный продукт при распаде цианогенного гликозида линамарина, содержащегося в корнях маниока. В живых клетках ацетон образуется в качестве метаболита самых разнообразных веществ — от пропана до аминокислоты лейцина (схема на рисунке 14). Соответственно, в следовых количествах ацетон присутствует и в человеческом организме, постоянно удаляясь с выдыхаемым воздухом и через кожу. Резкое накопление ацетона в тканях наблюдается при некоторых нарушениях обмена веществ. При сахарном диабете от человека пахнет ацетоном! В старину запах ацетона описывался как главный симптом этой болезни. Подвержен ацетон и биодеградации, в ряд стадий окисляясь до уксусной и пировиноградной кислот.
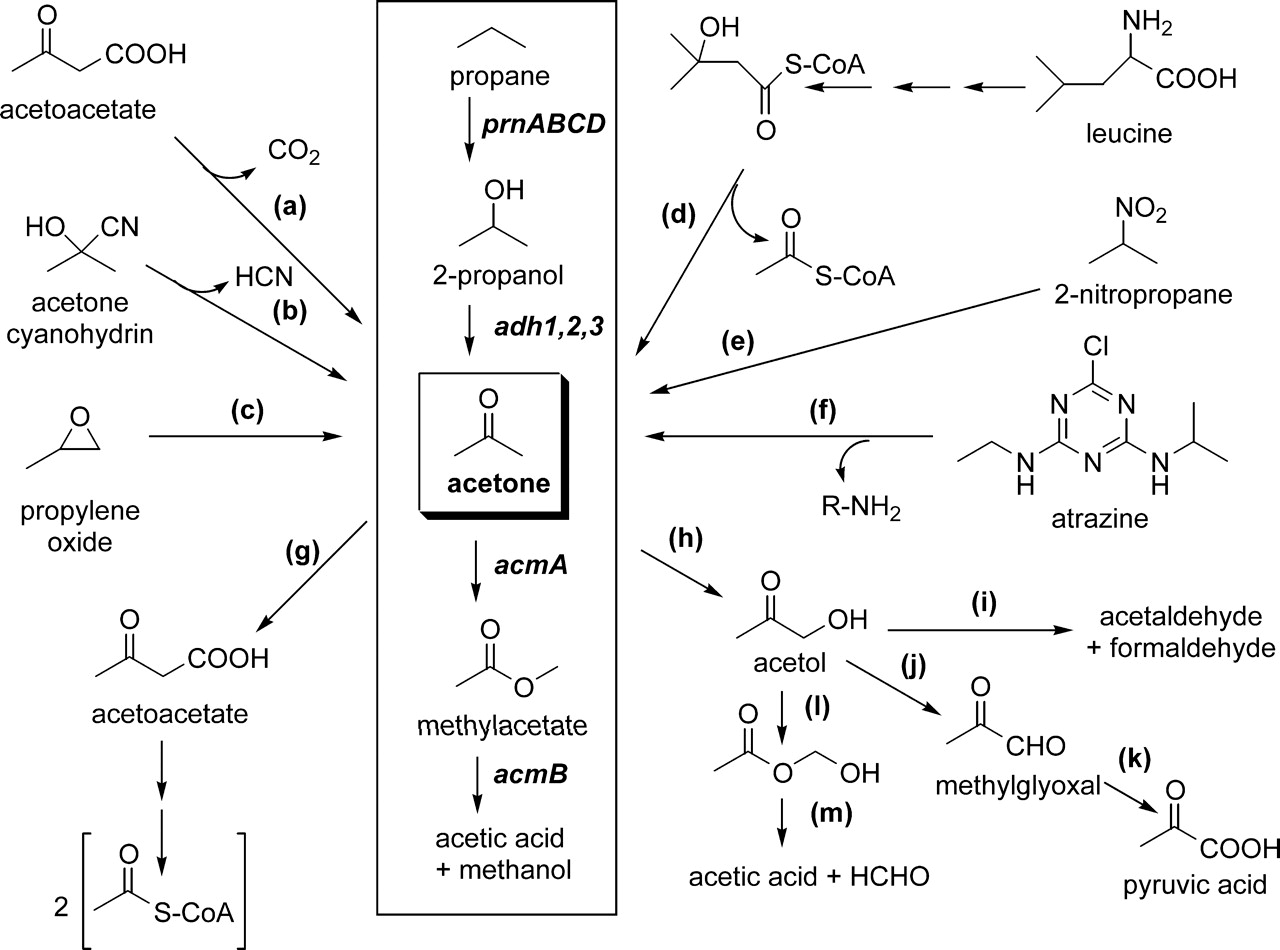
Рисунок 14. Ацетон является продуктом многих путей метаболизма и сам подвергается химическим превращениям в живых клетках
Лесная аптека
Фенацетин — один из старейших жаропонижающих и болеутоляющих препаратов (рис. 15а). Применять его начали еще в XIX веке, и тогда фенацетин вытеснил с полок аптек близкий по структуре, но более токсичный ацетанилид. Его основным метаболитом является другой широко известный лекарственный препарат — парацетамол, применяемый до сих пор при головной боли (рис. 15б). Как и большинство производных анилина, парацетамол и (в еще большей степени) фенацетин являются довольно-таки ядовитыми веществами. Передозировка приводит к поражению почек, что связано с образованием очень реакционноспособных хиноновых производных. Поэтому, фенацетин устарел и во многих странах, в том числе в России, снят с продажи.

Рисунок 15. Bursera grandifolia. а — Фенацетин; б — парацетамол.
Итак, фенацетин применяли более ста лет, и никто не искал его в природных источниках.
В Центральной Америке растут могучие деревья из рода бурзера Bursera grandifolia (рис. 15). Деревья эти — лекарственные, поскольку при ранении выделяют ароматную смолу, обладающую целебными свойствами. И вот оказалось, что смола бурзеры содержит метаболит п-этоксиацетанилид, идентичный препарату фенацетину! Вероятно, он-то и придает смоле растения жаропонижающее действие. Получается, что природа и человек независимо создали одно и то же соединение. Стоит ли говорить о том, что природа сделала это намного раньше? Хотя надо отдать должное и человеку — объемы производства препаратов позволяют получать их в больших количествах и уж точно в более высоких концентрациях.
Нестойкий оловянный солдатик
Если кто-то из читателей внимательно рассматривал Периодическую таблицу Менделеева, он наверняка заметил в ней раздел «Летучие водородные соединения». Почему именно этому классу веществ выпала честь присутствовать в самой фундаментальной для химии классификации? Потому что число атомов водорода в них точно соответствует низшей степени окисления атомов элементов той или иной группы таблицы. К образованию летучих водородных соединений склонны элементы большинства главных подгрупп — так называемые p-элементы. Соединения эти на редкость соответствуют названию: они содержат водород и атом p-элемента, то есть являются так называемыми «бинарными» соединениями. И они действительно летучие — все являются либо газами, либо летучими жидкостями. Дело в том, что молекулы этих веществ связаны между собой только непрочными ван-дер-ваальсовыми (в некоторых случаях водородными) связями. Летучие водородные соединения являются предельно восстановленными соединениями своих элементов. К ним относятся широко известные вещества — вода, аммиак, метан, сероводород, хлористый водород (растворением последнего в воде получают соляную кислоту). Существует правило: чем тяжелее элементы и, соответственно, чем больший радиус имеют их атомы, тем ниже стабильность водородных соединений. Если метан и вода очень стабильны и с трудом вступают в химические реакции (по крайней мере, в нормальных условиях), то летучее водородное соединение тяжелого p-элемента олова — станнан (рис. 16, слева вверху) — отличается химической агрессивностью. Это газообразное вещество является восстановителем, сравнимым со щелочными металлами, самовозгорается на воздухе и реагирует с водой, а с кислородом взаимодействует со взрывом очень большой мощности. Термодинамическая устойчивость станнана настолько низкая, что даже при комнатной температуре в анаэробных условиях этот газ постепенно распадается на молекулярный водород и металлическое олово (реакция оловянного зеркала), поэтому хранить его длительное время невозможно. При температуре 150 °С распад становится мгновенным, выше этой температуры существование молекул SnH4 невозможно. Естественно, станнан обладает экстраординарной токсичностью, сравнимой с летучими соединениями мышьяка. С таким набором свойств станнан не находит применения в промышленности, а в лабораториях ограниченно используется для получения оловоорганических соединений.

Рисунок 16. Сбор выброшенных на берег водорослей Enteromorpha prolifera. Слева вверху — станнан.
Казалось бы, какое отношение такое вещество может иметь к живой природе? Тем не менее, вполне возможно, имеет! Коллектив американских авторов проводил исследования по биометилированию олова. Для этого осуществляли ферментацию морских водорослей Enteromorpha sp. (которые, согласно утверждению авторов, накапливают олово в своих тканях) (рис. 16) в аэробных и анаэробных условиях.
Вообще, биологическое метилирование — довольно распространенный среди микроорганизмов способ обезвреживания токсичных элементов: не только олова, но и кадмия, свинца, ртути, селена. Метильные производные этих элементов, так же как и водородные соединения большинства из них, являются летучими веществами, и быстро испаряются в атмосферу. Скажете, что это приводит к загрязнению воздуха? Безусловно, но микробам все равно — они-то очищают собственную среду обитания. Поэтому, биометилирование является одной из угроз, связанной с загрязнениями тяжелыми металлами.
Так вот, коллектив авторов исследовал биометилирование олова в разлагающихся водорослях, чтобы оценить связанный с этим экологический риск. Образующиеся летучие соединения улавливались газовым хроматографом. Беспристрастный прибор выводил на хроматограмме сигналы ожидаемых веществ — тетраметилолова, триметилолова, диметилолова, монометилолова... Следующим членом ряда является станнан, в котором вообще нет метильных групп, но его-то никто не ждал. Дело в том, что алкильные радикалы сильно стабилизируют подобные молекулы. Просто никто не думал, что крайне реакционноспособный незамещенный станнан может образоваться естественным путем!
Но прибор выдал сигнал станнана, хотя и слабенький. Значит, станнан является природным веществом! Крошечная интенсивность сигнала смущать не должна — нужно помнить, сколько миллионов тонн водорослей гниют в океанах и на их берегах. На самом деле, опубликованная в Nature статья скорее задает вопросы, чем отвечает на них. Никто не знает механизм образования станнана. В нем участвуют микроорганизмы? Или это чисто химический процесс восстановления в строго анаэробных условиях? Авторы «подозревают» бактерий метаногенов, ссылаясь на структурное сходство станнана и метана. Так ли это — покажут дальнейшие исследования. Выше я упомянул о том, что бактерии метилируют не только олово, но и его еще более тяжелый аналог — свинец. Означает ли это, что список природных соединений может пополниться еще более реакционноспособным, опасным в обращении и токсичным газом плюмбаном PbH4? Думаю, это вполне возможно. Но, скорее всего, плюмбан образуется в еще меньших концентрациях, чем станнан, и обнаружит его новое поколение аналитических приборов, которые еще не созданы. К тому же, сделать это можно только где-нибудь в Арктике или Антарктике, в сообществах холодолюбивых микроорганизмов-психрофилов — плюмбан неустойчив настолько, что полностью разлагается при температуре ниже комнатной.
Еще одно чудо природы
В таблице Менделеева (которой, между прочим, в нынешнем году исполнилось 150 лет!) набралось уже больше сотни элементов. И каждый имеет свой, неповторимый набор свойств. Но если спросить, какой же химический элемент самый необычный из всех, то, пожалуй, правильным ответом будет — углерод. Именно углерод является самым продуктивным элементом по числу соединений. Настолько, что его химию выделили в отдельный раздел — органическая химия. В настоящее время известно несколько сотен тысяч неорганических соединений (образованных сотней элементов, исключая углерод) и около сотни миллионов (!) органических соединений углерода! Секрет углерода кроется в способности его атомов образовывать стабильные цепочки, кольца и каркасные структуры, а также кратные связи — одинарные, двойные и тройные. То есть из углеродных атомов, как из детского конструктора, можно произвести практически бесконечное число структур, и большинство из них будут достаточно устойчивы, чтобы быть выделенными и охарактеризованными. И это справедливо не только для классических органических веществ, но и для многочисленных аллотропных модификаций углерода. Или оксидов углерода.
В самом деле, сколько их — соединений углерода с кислородом? Нам привычны два — углекислый газ СО2 и угарный газ СО. Но в действительности их не один десяток — это не полностью окисленные оксиды или субоксиды, содержащие связи углерод—углерод. Некоторые из них представляют собой довольно сложные по строению молекулы. Например, меллитовый ангидрид содержит даже бензольное кольцо! Однако химики привыкли рассматривать субоксиды углерода исключительно как экзотические продукты синтеза. А оказалось, что они есть и в природе.
Цветок морозник красив и может стать украшением сада (рис. 17, слева). Названо так растение неслучайно — в условиях мягкого климата Южной Европы, Крыма или Кавказа оно действительно зацветает зимой. Но, как все представители семейства лютиковых (Ranunculaceae), под вызывающей симпатию внешностью морозник таит угрозу — растение ядовито, содержит сильнодействующие алкалоиды и гликозиды. В корневищах морозника красноватого (Helleborus purpurascens), содержатся необычные метаболиты поликетидной природы. При попадании в организм животного или человека они окисляются, и образуются макроциклические субоксиды углерода (МЦС) состава (С3О2)6 (так называемые МЦС-18) и (С3О2)8 (МЦС-24), по своей структуре беспрецедентные для живой природы (рис. 17, справа). Конечно, растение образует подобные вещества не для того, чтобы удивить биохимиков. Данные субоксиды являются ингибиторами АТФаз и во многом определяют токсичность морозника. А медики, узнав о них, заинтересовались и стали создавать новые лекарства для лечения аутоиммунных заболеваний (в частности, рассеянного склероза) — не даром разные виды морозников издавна известны и как лекарственные травы!
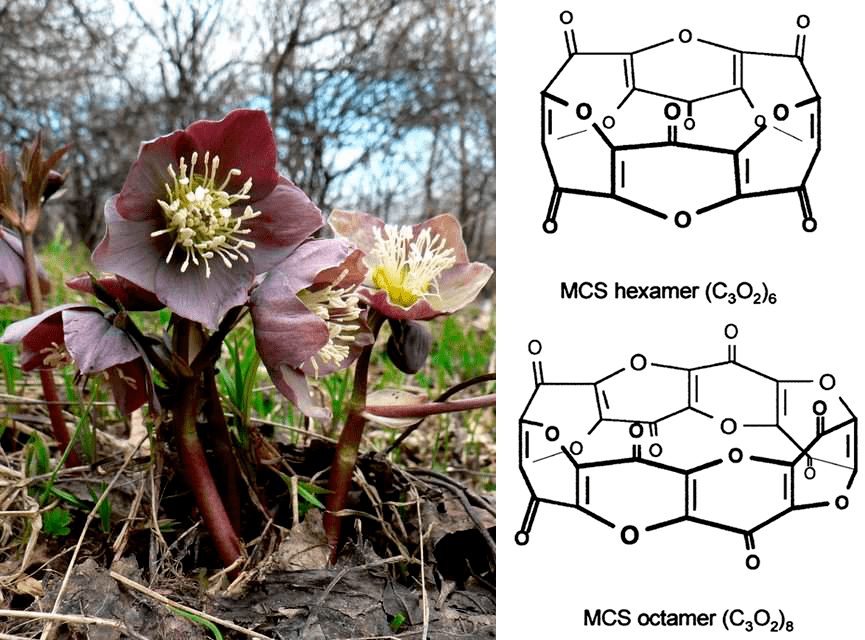
Рисунок 17. Морозник красноватый (слева) и гексамер и октамер С3О2 (справа)
Молекулярные чаши
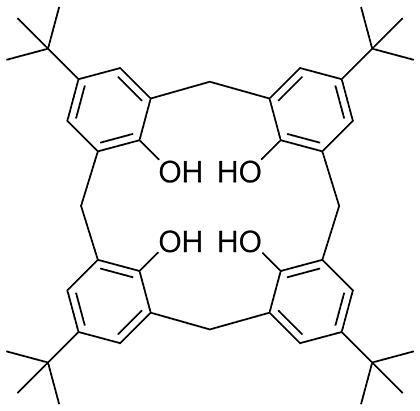
Рисунок 18. Структура каликсарена, полученного конденсацией п-трет-бутилфенола и формальдегида. Полное название этой молекулы весьма мудреное: 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетрагидроксикаликс[4]арен.
Фенолформальдегидные пластмассы подверженны биодеградации. Вообще, фенолы и альдегиды склонны к реакциям конденсации друг с другом, при этом образуется полимер (или олигомер, в зависимости от условий) и побочный продукт — вода. Но высокомолекулярные соединения, подобные фенолформальдегидным смолам, — только один из многих вариантов конденсации. Иногда она приводит к удивительно красивым и функциональным молекулам, таким, как каликсарены. Впервые эти соединения получили в 1956 году. Название «каликсарен» (calixarene) впервые было предложено в 1989 году и происходит от латинского слова calix («чаша»), что отражает особенную форму молекулы (рис. 18), и слова arene («арен»), указывающего на ароматический строительный блок данного соединения. Химикам известно несколько групп соединений, молекулы которых имеют форму чаши со свободным пространством внутри. К ним относятся природные вещества циклодекстрины, образующиеся при ферментативной обработке обычного крахмала; кукурбитурилы — уже неизвестные в природе соединения, продукты конденсации мочевины, глиоксаля и формальдегида. Первооткрывателям этого класса веществ их молекулы показались похожими формой на тыкву (латинское cucurbita). Отсюда и название. Есть еще краун-эфиры — эффективнейшие комплексообразователи для ионов металлов, а также ряд природных антибиотиков пептидной и эфирной природы.
И еще один класс, пожалуй, наиболее интенсивно изучаемый в настоящее время — каликсарены, о которых идет речь. Количество звеньев в молекулах каликсаренов колеблется от 3 до 20, но чаще всего встречаются молекулы с 4, 6 и 8 звеньями. По принятой номенклатуре их называют «каликс[4]арены», «каликс[6]арены» и т.д. Внутренняя полость молекулы каликсарена имеет объем, в среднем равный 10 кубическим ангстремам. И это позволяет каликсаренам быть превосходными комплексообразователями — молекулярная чаша легко заполняется молекулярным содержимым. И не просто комплексообразователями, а катализаторами реакций — каликсарены часто сравнивают с активными центрами ферментов! Способность сорбировать строго определенные молекулы позволяет использовать каликсарены в качестве сенсоров.
В настоящее время каликсарены известны только как продукт синтеза. В природе они не обнаружены. Однако похожие на них молекулы все-таки найдены.
Биологов издавна манили острова. И дело не только в романтике странствий — на любом более-менее крупном и удаленном от континентов острове эволюция формирует комплекс видов-эндемиков, встречающихся только на нем. Остров Сокотра в Индийском океане не стал исключением. Особенно интересны уникальные растения Сокотры. Это бутылочные деревья, запасающие воду в стволах и имеющие необычный облик. Но символом острова является «драконье дерево» Dracaena cinnabari Balf. — дальний родственник спаржи (рис. 19). Это растение тоже выглядит необычно. Деревья часто сравнивают формой с гигантскими грибами. Но главное, драценам издревле находилось применение — еще в античности из них получали «драконью кровь». Так называется смола ярко-красного цвета, выступающая из ран, нанесенных драцене, и обладающая целительными (в первую очередь, антисептическими) свойствами.
Так вот, в литературе есть сведения о присутствии в смоле драцены метаболита, названного дракофаном. Представляет он собой циклический полифенол (3,12,21-тригидрокси-1,10,19-трис(4-гидроксифенил)-5,14,23-триметокси[3,3,3]метациклофан), обладающий необыкновенно симметричной структурой, напоминающей каликсарен (рис. 19, справа внизу). Хотя, конечно, дракофан каликсареном не является, и даже образуется по-другому — не сополимеризацией фенола и альдегида, а тримеризацией другого природного фенола — халькана. Сразу бросается в глаза, что молекула состоит из трех повторяющихся звеньев. И тем не менее его молекула тоже имеет чашеобразную форму с полостью внутри. Вполне вероятно, что дракофан также комплексообразователь. Вероятно, он и сходные с ним фенолы определяют лекарственные свойства «драконьей крови».
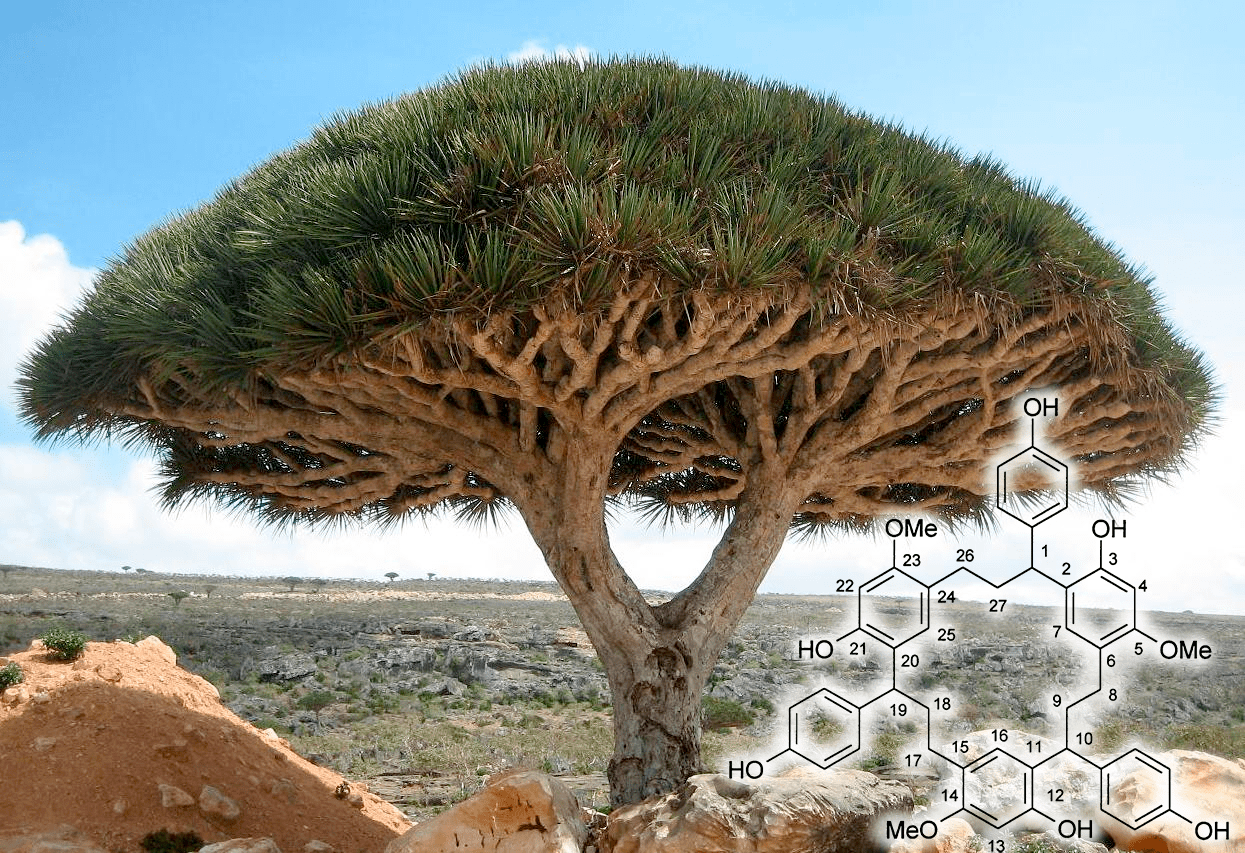
Рисунок 19. Драцена и дракофан (справа внизу)
Интересно, что уже известен и настоящий каликсарен, полученный из природных веществ (рис. 20а). Японским исследователям удалось получить его из альдегида ванилина (рис. 20б, слева вверху) — того самого, что добывается из цветков орхидеи ванили (рис. 20б) и высоко ценится кондитерами, — и фенола пирогаллола (рис. 20в, слева внизу), добываемого из таннинов дубовых галлов (рис. 20в и 20г), в присутствии сильной кислоты. То есть теоретически каликсарены могут образовывать и живые организмы — кислоту вполне может заменить фермент.
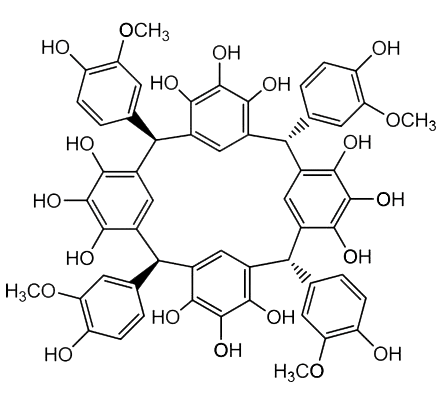
Рисунок 20а. Структура каликсарена, синтезированного из природных веществ пирогаллола и ванилина
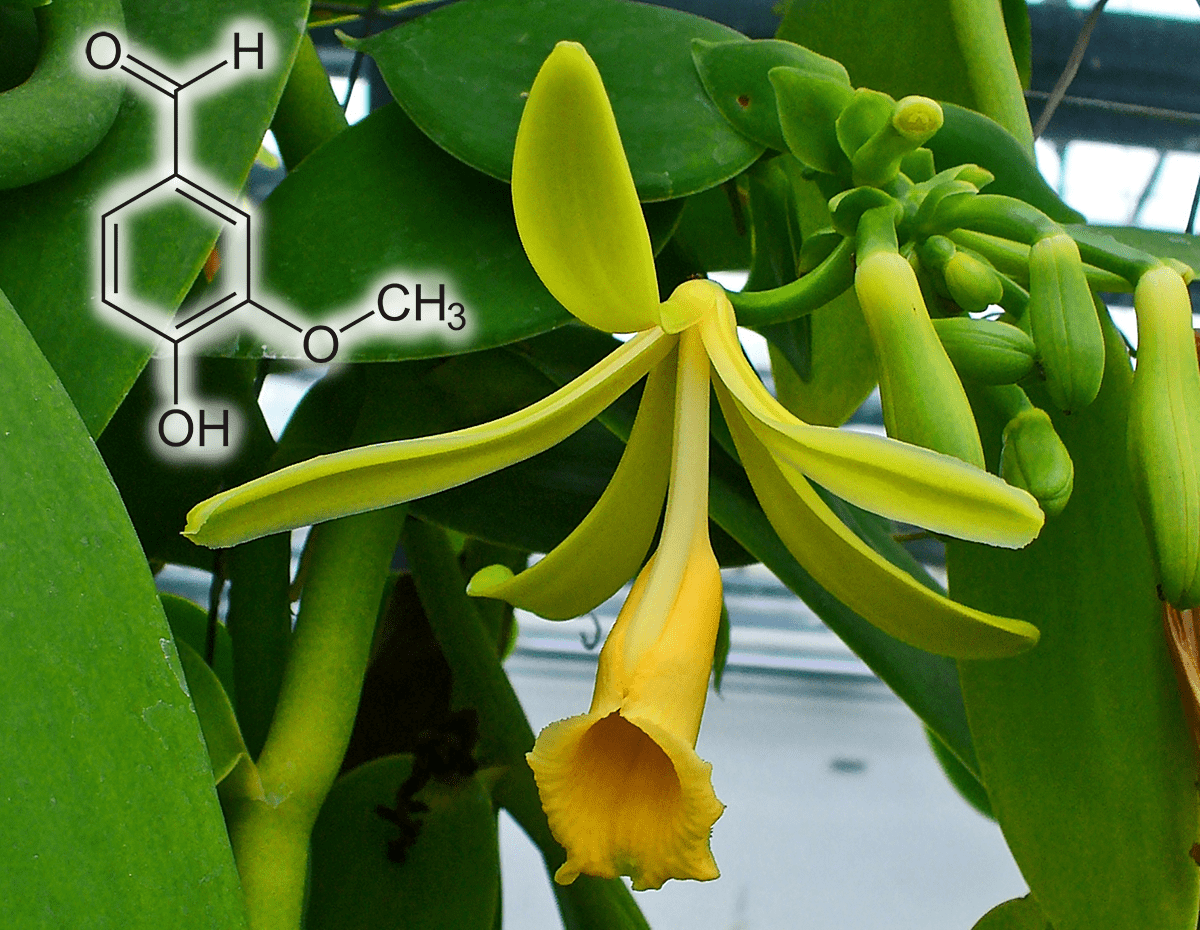
Рисунок 20б. Ваниль душистая (Vanilla planifolia) — один из источников ванилина (слева вверху)
Неопалимая купина — реальность? Или нет?
Каждый из нас слышал легенду о неопалимой купине — терновом кусте, объятом пламенем, но не сгорающем. Легенда объясняет это явление чудом, но у чуда есть реальные прообразы. Существуют растения, выделяющие легковоспламеняющиеся эфирные масла. Например, красивый (но ядовитый) цветок ясенец белый (Dictamnus albus) буквально окутывает себя облаком из фитонцидов. Если к кусту ясенца поднести зажженную спичку, вокруг него вспыхнет и моментально погаснет пламя. Некоторые богатые эфирными маслами кустарники в составе произрастающего в Калифорнии чапараля, можно сказать, нарочно провоцируют пожары — без них не будут распространяться их семена.
Но даже зная об этом, я был немало удивлен, когда узнал, что несколько видов растений семейства бобовых выделяют сероуглерод и карбонилсульфид (рис. 21 а и б). По химическому строению сероуглерод — это, фактически, углекислый газ, в котором атомы кислорода замещены серой. Сходство строения определяет некоторое сходство свойств — CS2, подобно CO2, является кислотным ангидридом и дает ряды солей: дитио- и тритиокарбонатов. На этом, пожалуй, сходство заканчивается. Высокочистый сероуглерод — очень летучая бесцветная жидкость с приятным запахом, похожим на фруктовый. Но при хранении, особенно на свету, сероуглерод разлагается, приобретает желтоватый цвет и неприятный запах редьки. Сероуглерод очень легко воспламеняется, а смеси его паров с воздухом взрывоопасны. Из всех используемых растворителей именно сероуглерод признан самым огнеопасным, в этом он превосходит даже диэтиловый эфир.
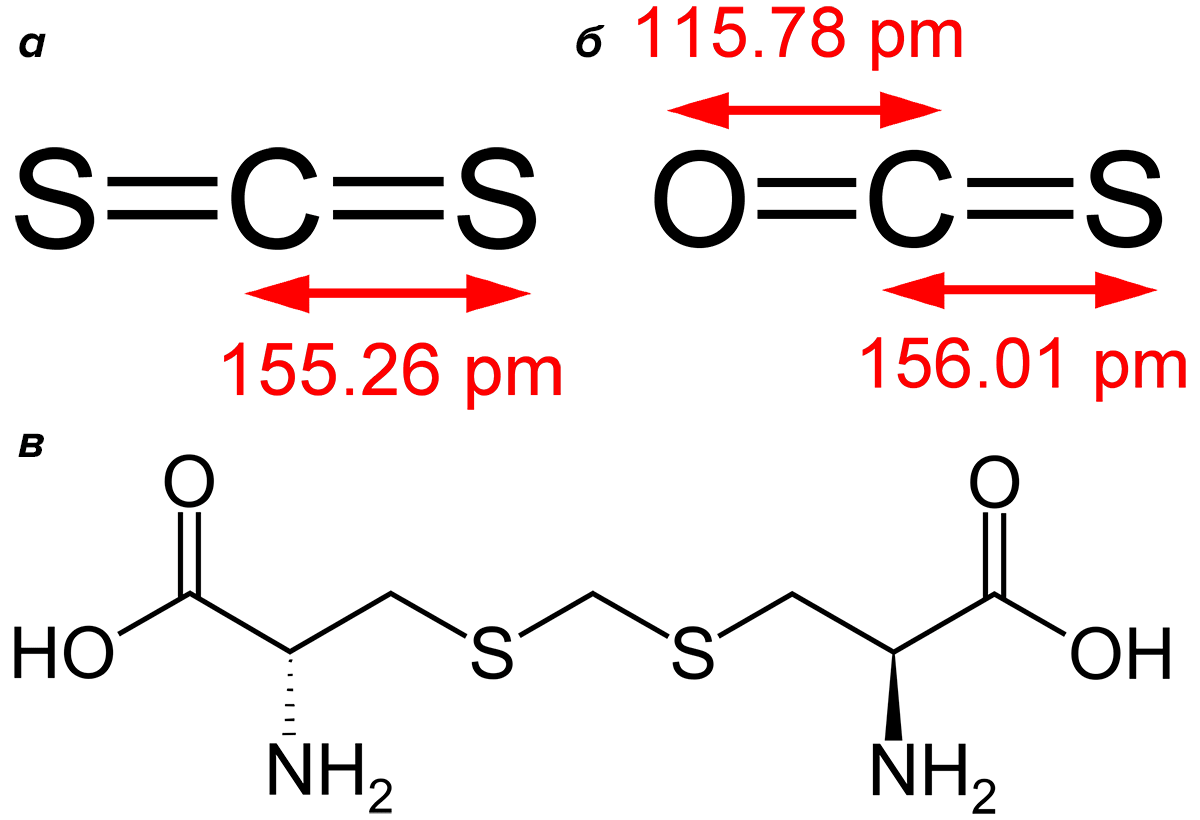
Рисунок 21. Сероуглерод (а), карбонилсульфид (б) и дьенколевая кислота (в) — биохимический предшественник сероуглерода из растений семейства бобовых
Существует довольно-таки распространенное заблуждение, будто бы сероуглерод горит холодным пламенем, в котором даже не загорается бумага. В действительности, холодное пламя наблюдается только при очень низких концентрациях паров сероуглерода, когда количества вещества не хватает для выделения значительного тепла. С ростом концентрации пламя становится вполне себе горячим. К тому же сероуглерод ядовит. На коже оставляет химические ожоги и вызывает дерматиты. Как и многие другие растворители, поражает печень и оказывает угнетающее, наркотическое действие на нервную систему.
Возникает вопрос: почему вещество с таким опасным набором свойств вообще используется? Более того, является крупнотоннажным продуктом химического производства! Во-первых, способность сероуглерода образовывать эфиры тиоугольных кислот делает его незаменимым в производстве вискозного волокна — именно на него уходит бóльшая часть производимого сероуглерода. Во-вторых, следует иметь в виду его уникальную растворяющую способность. Некоторые вещества — ромбическая сера, белый фосфор — плохо растворяются в органических растворителях и практически не растворяются в воде, но прекрасно растворимы в CS2. С аминами сероуглерод образует тиурамдисульфиды. Некоторые их представители, такие как тиурам, — фунгициды и инсектициды. Дисульфирам используется как средство от алкоголизма.
И вот выяснилось, что стыдливая мимоза (рис. 22) — растение из семейства бобовых, родиной которой является Тропическая Америка, — среди прочих высокотоксичных веществ выделяет сероуглерод. Это растение каждому известно со школы благодаря своей удивительной способности, недоступной большинству других растений. При прикосновении листья мимозы моментально складываются. И в этот момент растение выделяет ядовитый «коктейль», содержащий в том числе пары сероуглерода. Это вещество, весьма неожиданное для живой природы, образуется при распаде непротеиногенной (то есть не содержащейся в белках), но содержащей серу аминокислоты — дьенколевой кислоты (рис. 21в). Сказать по правде, я никогда не слышал про объятые пламенем мимозы: возможно, концентрация продуцируемого ею сероуглерода слишком мала для возгорания. И тем не менее подобное вполне возможно, учитывая горючесть паров CS2.

Рисунок 22. Мимоза стыдливая в цвету
Сероуглерод не только вырабатывается растениями, но и подвергается микробной биодеградации: гидролизуется серными бактериями до углекислого газа и сероводорода, а последний окисляется до элементной серы или сульфата. Промежуточным продуктом гидролиза сероуглерода является карбонилсульфид — очень ядовитый и огнеопасный газ, который, таким образом, тоже является природным веществом.
Самый маленький алмаз
На вопрос «Какой алмаз самый крупный?» можно ответить без труда: это Куллинан, обнаруженный в начале прошлого века в Южной Африке и весивший больше 3000 карат. Кстати, считается, что Куллинан сам являлся осколком гораздо более крупного алмазного кристалла, который не был найден. А вот какой алмаз самый маленький? Для ювелира сама постановка вопроса покажется нелепой, а вот для ученого этот вопрос вполне здравый. И правильный ответ на него: самый маленький алмаз, весом примерно 1×10–21 карат, — это молекула адамантана (рис. 23, справа внизу). Само название «адамантан» образовано от греческого названия алмаза. Химическое название этого углеводорода с формулой С10Н16 — трицикло[3.3.1.13.7]декан, — и он представляет собой ячейку кристаллической решетки алмаза.

Рисунок 23. Бриллиант. Чарующая игра света на его гранях объясняется уникальным коэффициентом преломления света в алмазе. Справа внизу: адамантан — уникальное своей термодинамической устойчивостью органическое соединение. Молекула представляет собой фрагмент кристаллической решетки алмаза.
Можно предположить, что родство с самым дорогим и воспетым в легендах минералом (рис. 23) должно и адамантан наделить необыкновенными свойствами. И это соответствует действительности. Алмаз и адамантан объединяет необыкновенная термодинамическая стабильность. Алмаз (рис. 24) — самая химически инертная аллотропная модификация углерода. Адамантан — одно из самых стабильных органических веществ. Выдерживает нагрев до 660 °С, и не разлагается! Дело в том, что адамантановый каркас, состоящий из четырех циклогексановых колец, обладает уникальным сочетанием свойств. С одной стороны, он жесткий и не подвержен конформационным изгибам. С другой стороны, все связи в этом каркасе находятся под оптимальными углами и не напряжены. Именно по этой причине, когда в 1924 году существование адамантана было предсказано, химики сразу выразили удивление, почему этот углеводород еще не синтезирован и не обнаружен в природе. Из нефти адамантан выделили в 1933 году, но концентрация его в природных нефтях настолько низкая, около 0,0001%, что получать его из природных источников нерентабельно. Редкость тоже сближает адамантан с алмазом! А синтезировал адамантан впервые именитый хорватский химик Владимир Прелог в 1941 году. Необыкновенная симметрия молекул адамантана позволяет им плотно упаковываться в кристалле, и этим объясняется очень высокая для углеводорода температура плавления — 268 °С. Для сравнения, н-декан, тоже состоящий из десяти атомов углерода и близкий к адамантану по молекулярной массе, представляет собой жидкость, замерзающую при –28 °С.
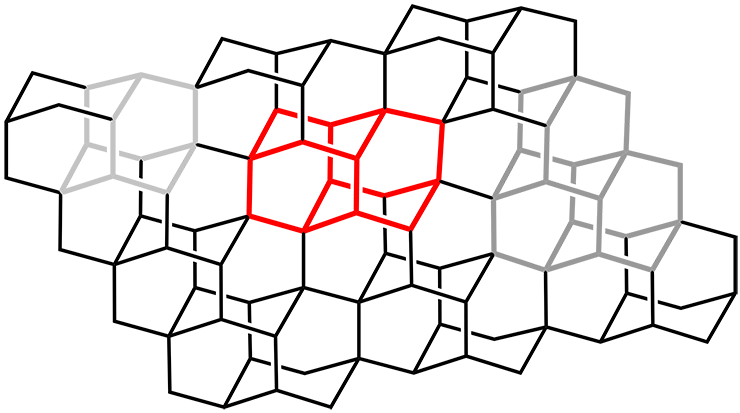
Рисунок 24. Фрагмент кристаллической решетки алмаза и три члена ряда углеводородов-адамантоидов: светло-серым цветом слева выделен адамантан, красным в центре — диамантан (конгрессан), темно-серым справа — триамантан. С точки зрения органической химии, алмаз — высший член этого ряда.
Драгоценным камням, и алмазу в том числе, издревле приписывались чудодейственные лечебные свойства. Современная наука относится к этим поверьям со скепсисом. Но для целого ряда производных адамантана такие свойства известны! Амантадин (адамантиламин), например, используется для лечения гриппа, так же как более известный римантадин. Вилдаглиптин применяется при сахарном диабете, а мемантином лечат пациентов с синдромом Альцгеймера.
Конечно, издревле лечили не только драгоценными каменьями, но и травами. В этом случае наука очень даже поддерживает народные поверья. Из народной медицины в официальную пришло многое. Все мы знаем о целебных свойствах зверобоя. Удивительно, но произрастающее в пустынях Египта и Палестины растение зверобой синайский Hypericum sinaicum (рис. 25) содержит ряд метаболитов, представляющих собой замещенный адамантан (рис. 25, справа вверху). То есть живые организмы способны в своих клетках синтезировать алмазоподобные структуры! Правда, и в них, как и везде, эти структуры очень редки. До сих пор производные адамантана обнаружены только в растениях из рода зверобой (Hypericum) и их близких родственниках из тропиков, относимых к роду клузия (Clusia) (рис. 26). Возможно, именно они придают фармацевтические свойства некоторым растениям.

Рисунок 25. Зверобой синайский, продуцент адамантаноидов, и синаицинон (справа вверху) — адамантановое производное, выделенное из зверобоя

Рисунок 26. Клузия — продуцент адамантаноидов
Но живые организмы не только синтезируют адамантоиды. Бактерии Mycobacterium sp. AGS10 обладают уникальной способностью расти в средах, содержащих в качестве единственного источника углерода каркасные углеводороды 1-метиладамантан, 1,3-диметиладамантан и 1,3,5-триметиладамантан. Условия культивирования — аэробные, среда сильнокислая (рН 2,5). До сих пор биодеградацию адамантанов наблюдали исключительно в присутствии других источников углерода. Исходя из этих данных, можно пофантазировать на тему... биодеградации алмазов. Алмазы являются самой стабильной формой углерода в природе, существуют сотни миллионов лет и не подвергаются заметной деструкции. Но теоретические предпосылки даже для их биодеградации (пусть даже исключительно медленной), таким образом, существуют! Тем более что для других, менее инертных аллотропных модификаций углерода (углеродные нанотрубки, фуллерены, окисленный графен), биодеградация уже известна. Биологическая деструкция адамантанов свидетельствует о том, что, фактически, микробы могут «справляться» с любой, даже самой инертной формой углерода.
Азот да не тот
Галимедин — первое и на сегодняшний день единственное природное производное симметричного триазина. В ней я высказал сомнение в том, что триазиновый цикл действительно синтезируется живым организмом. Возможно, галимедин — это метаболит искусственного пестицида. Однако образование в природе, по крайней мере, одного вещества с триазиновым циклом, пусть даже традиционно не относимого к природным, все-таки засвидетельствовано. Меламин не стоит путать с меланином — это совершенно разные вещества. В отличие от природных темных пигментов, меламин (2,4,6-триамино-1,3,5-триазин) представляет собой бесцветные кристаллы и известен как синтетическое вещество. Подобно фенолам, меламин хорошо конденсируется с формальдегидом — эта реакция используется в производстве меламиноформальдегидных смол. Например, широко известен пенопласт «меламиновая губка» как раз на их основе, применяемый для тепло- и шумоизоляции. Из меламиноформальдегидных смол делают и посуду — красивую, похожую на фарфоровую, легкую и небьющуюся, но далеко не безопасную для здоровья (рис. 27). Реакция конденсации формальдегида и меламина обратима, и такая посуда постоянно продуцирует формальдегид!

Рисунок 27. Посуда из меламиноформальдегидной пластмассы
А подвергая меламин пиролизу, можно получить совсем уникальный полимер, состоящий только из углерода и азота — графитоподобный нитрид углерода.
В 2008 году вокруг меламина разыгрался скандал. Выяснилось, что недобросовестные производители из Китая добавляли его в продукты питания — молоко, детское питание, шоколад. Зачем? Все просто. Ряд лабораторных методов оценки качества продуктов основан на содержании в них азота. При этом априори считается, что весь азот в продуктах включен в состав белка. То есть чем больше в пробе азота, тем пища богаче белком — самым ценным компонентом. Меламин очень богат азотом, и внесение совсем незначительных его количеств может резко увеличить концентрацию этого элемента, то есть обмануть тесты. Хотя к белку этот азот отношения не имеет, а на качество продукта меламин может оказать только отрицательное влияние, пусть даже он сравнительно малотоксичен.
Сырьем для производства меламина является цианамид. И вот тут начинается самое интересное для нас. В представлена схема биодеградации взрывчатого вещества нитрогуанидина микрофлорой активного ила (рис. 28). Я привожу здесь эту схему в несколько упрощенном виде. Главными продуктами деструкции являются азотистые основания гуанидин и цианамид. А цианамид далее может подвергаться димеризации до цианогуанидина и тримеризации до меламина.
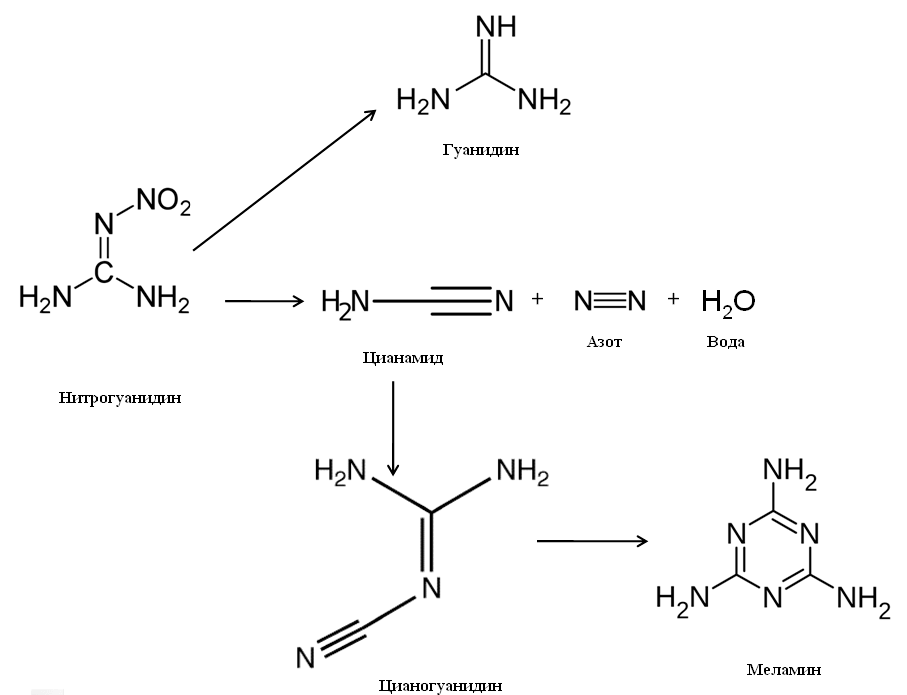
Рисунок 28. Схема биодеградации нитрогуанидина
Конечно, может последовать возражение: все эти вещества не являются природными, потому что образуются при деградации рукотворного, химического продукта. Однако это не так. Промежуточные продукты деструкции — цианамид и цианогуанидин, являющиеся предшественниками меламина, — найдены в растениях семейства бобовых, например, в мышином горошке Vicia cracca (рис. 29). Соответственно, и меламин может получаться из природных веществ. Возможно, он даже присутствует в следовых количествах в том же мышином горошке. Гуанидин — очень сильное органическое основание, фактически, щелочь, тоже является природным веществом. Он выделяется из организма с мочой как продукт белкового обмена.

Рисунок 29. Мышиный горошек
Стоит ли говорить о том, что сам меламин (и даже меламинформальдегидные смолы!) тоже разлагается микроорганизмами?
Прорыв в медицине
В наш просвещенный век даже представить сложно, что когда-то хирургические операции проводились без анестезии. Конечно, обезболивающие вещества (начиная с водки и заканчивая опием) и обезболивание использовались издревле. Но эффективность этих средств была низкой, и любое хирургическое вмешательство было пыткой для пациента. Настоящим прорывом в медицине стало применение ингаляционного наркоза. В 1847 году, в самый разгар Кавказской войны, двое великих русских хирургов — Федор Иванович Иноземцев и Николай Иванович Пирогов — впервые успешно применили для этой цели диэтиловый эфир (эфирный наркоз). Эффективность наркоза была настолько велика, равно как интерес врачей, что буквально в том же году был внедрен второй наркотический анестетик — хлороформ. Хлороформ эффективнее эфира, к тому же менее опасен в обращении — эфир чрезвычайно пожаро- и взрывоопасен. Уже много позже на смену хлороформу пришли еще более безопасные анестетики — этилхлорид, циклопропан, галотан, изофлуран, закись азота, инертный газ ксенон. Почетное место среди них занял трихлорэтилен — очень эффективный препарат. Но трихлорэтилен используется не только в медицине — это практически негорючий растворитель.
А что происходит с трихлорэтиленом, если он попадает в организм? Вопрос отнюдь не праздный, если учесть медицинское применение этого вещества. Ответ прост — как и многие другие органические растворители, трихлоэтилен хорошо смешивается с жирами и практически не смешивается с водой. Это серьезно затрудняет его выведение из организма. Самая «жирная» часть нашего тела — головной мозг, и растворители скапливаются в нем, нарушая работу. Этим и объясняется их наркотический, опьяняющий и усыпляющий эффект. Нервная система страдает от растворителей в первую очередь, за ней следуют печень и почки — именно эти органы заняты детоксикацией и выведением из организма чужеродных веществ. В печени происходит ферментативное окисление растворителей до более гидрофильных веществ, которые далее выводятся из организма с мочой. Разумеется, эта защита экстренная и далеко не во всех случаях эффективная. Метиловый спирт, высочайшая токсичность которого обусловлена исключительно окислением до формальдегида. Этот пример, конечно, крайний случай. Продукты окисления других растворителей менее опасны, но тоже далеко не безобидны.
Трихлорэтилен окисляется в печени универсальным защитным ферментом — цитохромом Р450, — причем основными продуктами окисления являются хлораль и хлоральгидрат — вещества, давно и широко известные (рис. 30). Хлораль (2,2,2-трихлорацетальдегид) является сырьем в производстве пестицидов — ДДТ, хлорофоса и дихлофоса. Продукт гидратации хлораля — хлоральгидрат — является сильным снотворным. Возможно, действие хлоральгидрата основано на его дальнейшем метаболизме в спирт 2,2,2-трихлорэтанол (который, таким образом, является и метаболитом трихлорэтилена). Существует снотворный препарат триклофос, представляющий собой фосфорнокислый эфир трихлорэтанола — фосфорильная группа придает веществу дополнительную гидрофильность, позволяющую растворять препарат в воде. А в организме он метаболизируется опять-таки до трихлорэтанола, который и является действующим началом.
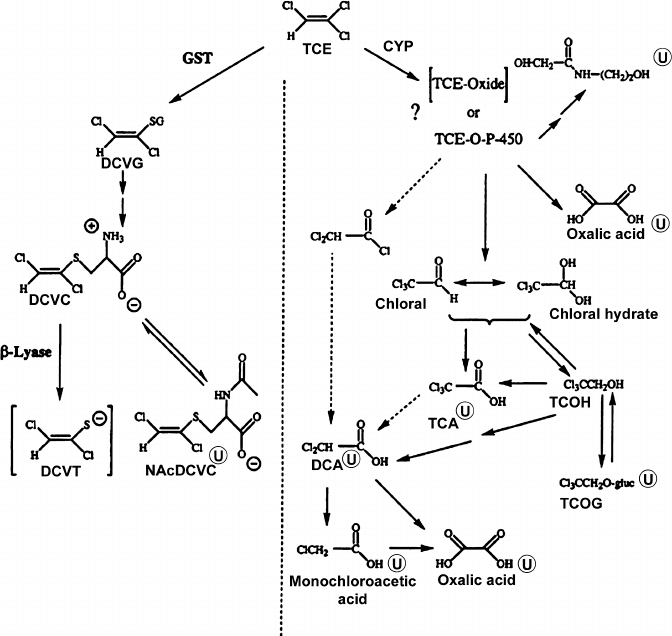
Рисунок 30. Метаболизм трихлорэтилена. Условные обозначения: ТСЕ — трихлорэтилен, ТСА — трихлоруксусная кислота, DCA — дихлоруксусная кислота, ТСОН — трихлорэтанол, TCOG — трихлорэтилглюкуронид, DCVG — дихлорвинилглутатион, DCVC — дихлорвинилцистеин, DCVT — дихлорвинилтиол, CYP — цитохром Р, GST — глутатионтрансфераза.
В этом месте внимательный читатель заметит противоречие. В самом деле, если рост гидрофильности веществ обусловлен их окислением, а восстановление, напротив, делает их липофильными, то почему хлоральгидрат в организме не окисляется, а восстанавливается? На самом деле, часть его все-таки окисляется до трихлоруксусной кислоты — одного из конечных метаболитов, выводимого с мочой. А гидрофильность трихлорэтанола увеличивается другим путем. Фермент глюкуронозилтрансфераза (рис. 31) переносит на гидроксильную группу спирта высокогидрофильный остаток сахара — глюкуроновой кислоты. Образуется хорошо растворимый в воде трихлорэтилглюкуронид (урохлоралевая кислота) — еще один конечный метаболит хлоральгидрата.
Рисунок 31. Фермент глюкуронозилтрансфераза, помогающий выводить токсины из организма
Но для нас важен еще один момент. Трихлорэтилен вырабатывается не только химической промышленностью. Это, ко всему прочему, метаболит морских водорослей, таких как Asparagopsis taxiformis (рис. 32). Соответственно, весь набор его метаболитов тоже можно считать природными веществами! Морские красные водоросли Falkenbergia (которые на поверку оказались не самостоятельным родом, а... стадией жизненного цикла все тех же Asparagopsis — вот так все сложно устроено у красных водорослей!) вырабатывают тяжелый аналог трихлорэтилена трибромэтилен — известный канцероген и мутаген, депрессант нервной системы. Его метаболический путь очень сходен, ведет к бромалю и бромальгидрату, используемых как анестетики в ветеринарии. В свою очередь, их активным метаболитом, оказывающим сильное седативное действие, является 2,2,2-трибромэтанол, известный под названиями «авертин», «ректанол» и «нарколан». Трибромэтанол известен как ректальный анестетик — он вводится пациенту в прямую кишку и вызывает глубокий сон. Таким образом, и метаболиты трибромэтилена тоже можно отнести к природным веществам.

Рисунок 32. Рыба Гарибальди Gypsypops rubicundus проплывает над зарослями красных водорослей Asparagopsis taxiformis. Побережье Калифорнии.
Но это еще не все! Сам трихлорэтилен, как уже говорилось выше, является негорючим и сравнительно инертным веществом. Но продукт его распада дихлорацетилен чрезвычайно активен и самовозгорается на воздухе (рис. 33а). Он образуется, например, при хранении трихлорэтилена на свету. В лабораториях дихлорацетилен получают, нагревая до температуры 120 °С смесь трихлорэтилена и твердой щелочи, например, едкого калия. Реакция расщепления трихлорэтилена до дихлорацетилена и хлористого водорода протекает строго по принципу Ле Шателье: система стремится гасить колебания. Поэтому, возрастание щелочности среды приводит к возникновению кислоты, нейтрализующей щелочь. А выделяющийся в пробирке дихлорацетилен дает эффектные вспышки.
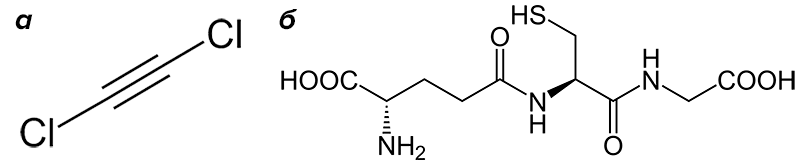
Рисунок 33. Дихлорацетилен (а) и глутатион (б). Глутатион — трипептид, состоящий из глутаминовой кислоты, цистеина и глицина, — выполняет в организме важнейшие функции: не только обезвреживает ксенобиотики, но и является антиоксидантом.
Если вглядеться в схему метаболизма трихлорэтилена на рисунке 30, то можно увидеть, что он не только окисляется, но еще и образует транс-1,2-дихлорвинильный аддукт с тиоловой группой глутатиона (рис. 33б). Такие аддукты очень похожи на результат присоединения дихлорацетилена. Возможно, он выделяется в организме как активный метаболит трихлорэтилена и обезвреживается глутатионом. Если окажется, что такой механизм взаимодействия трихлорэтилена и глутатиона верен, то тогда и дихлорацетилен можно будет отнести к природным веществам!
Красота требует жертв
Каждый из нас когда-то простужался и полоскал горло. Отваром ромашки, колендулы... Конечно, помним мы и ярко-желтые таблеточки фурацилина, окрашивающие в такой же цвет горячую воду. Специфическую желтую окраску фурацилину придает нитрогруппа, являющаяся хромофором (так называют группы, поглощающие свет определенной длины волны и придающие цвет веществам). Все нитросоединения имеют лимонно-желтый цвет, в щелочных условиях переходящий в красный — нитросоединение обратимо изомеризуется в нитроновую кислоту. Еще нитрогруппа придает веществу сильную токсичность — на этом основано антимикробное действие фурацилина. Некоторые нитросоединения (например, хлорпикрин — трихлорнитрометан) применяли в качестве боевых отравляющих веществ. 3-нитропропиловый спирт и β-нитропропионовая кислота являются токсинами растений из рода астрагал (Astragalus). Хлорамфеникол — эффективный антибиотик, продуцируемый стрептомицетами.
А еще (и это самое известное свойство!) нитрогруппа — сильный окислитель. Это немудрено, ведь обладающий высокой электроотрицательностью атом азота в ней имеет самую высокую степень окисления и стремится «вернуть» недостающие электроны. По этой причине большинство нитросоединений — легковоспламеняющиеся и взрывчатые вещества, способные гореть и в отсутствии кислорода. Все самые известные взрывчатки являются нитросоединениями — тротил (2,4,6-тринитротолуол), пикриновая кислота (2,4,6-тринитрофенол), — или близкими по свойствам эфирами и амидами азотной кислоты (нитроглицерин, нитроцеллюлоза, тетранитропентаэритрит, гексоген). Большинство анализаторов взрывчатых веществ «заточены» на обнаружение нитрогрупп!
И все-таки наше повествование посвящено не взрывчаткам, а широко разрекламированному средству для похудения 2,4-динитрофенолу (рис. 34). Печально знаменитому «жиросжигателю», из-за высокой токсичности ставшему причиной многих смертей. А те, кто не умер, стали похожими на больных желтухой — динитрофенол накапливается в кожных покровах и белках глаз, придавая им специфический для нитросоединений цвет. Действие динитрофенола основано на разобщении метаболических путей — энергия в организме перестает накапливаться в виде жира, а выделяется в виде тепла. Похожим действием обладает близкий по строению 4-нитрофенол (рис. 35), хорошо известный биохимикам, изучающим окислительное фосфорилирование в митохондриях.

Рисунок 34. Таблетки для похудения на основе динитрофенола и 2,4-динитрофенол (справа вверху)
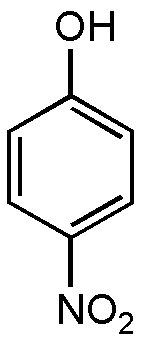
Рисунок 35. 4-нитрофенол (пара-нитрофенол)
Одним словом, на какие угодно жертвы можно пойти ради красоты! Хотя, на мой взгляд, нитрофенолы — не лучшее решение для реализации в общем-то хорошей мотивации сбросить лишний вес. Гораздо правильнее заняться физическими упражнениями и ограничить себя в калориях. Но история на этом не заканчивается. Оказывается, зловредное лекарство имеет близкие по структуре аналоги среди природных веществ! Арктическая морская бактерия Salegentibacter sp. T436 (рис. 36) вырабатывает целый ряд нитроароматических соединений, среди которых 6-метокси-2,4-динитрофенол и незамещенный п-нитрофенол. Смысл, вероятно, кроется всё в той же высокой токсичности этих веществ — бактерия применяет их как токсин или антибиотик. То есть биохимики, работающие с нитрофенолом, в большинстве своем не задумываются о том, что имеют дело с веществом, «идентичным натуральному»!

Рисунок 36. Оказывается, необычные природные соединения можно отыскать даже здесь
Небольшое отличие
Паракват (1,1′-диметил-4,4′-бипиридилия дихлорид) является одним из самых эффективных гербицидов (рис. 37). Он неспецифичен и подавляет рост любых сорняков, поскольку останавливает перенос электронов при фотосинтезе. Известны примеры, когда плантации наркоторговцев уничтожали, распыляя над ними паракват.

Рисунок 37. Распыление пестицидов над полем. Внизу: структурная формула параквата.
Но в ряде стран (в том числе в Российской Федерации) он запрещен к применению. Все дело в том, что паракват токсичен не только для растений. Чайная ложка параквата смертельна и для человека, вызывая острую почечную недостаточность. Поэтому к отравлению паракватом нередко прибегают самоубийцы. У насекомых это вещество вызывает сильнейший окислительный стресс. Впрочем, некоторые микроорганизмы способны обезвреживать паракват.
Вообще, многие производные пиридина (среди них немало и природных алкалоидов) являются сильными ядами. И тем не менее обнаружение в природе метаквата (1,1′-диметил-3,3′-бипиридилия), изомера параквата, вызвало удивление у ученых — этому событию даже посвящено краткое сообщение (рис. 38а). Впрочем, не совсем в природе. Все-таки без деятельности человека здесь не обошлось. Метакват выделили из растительного яда, которым смазывают стрелы охотники с островов Ментавай (рис. 38б), расположенных рядом с Суматрой. А вот из каких именно растений происходит метакват? Или может быть, он образуется из каких-то предшественников в процесс приготовления яда? Пока не ясно. Но известно одно — метакват, как и его изомер, ядовит. Действие его сходно с действием кураре, который аналогичным образом используют южноамериканские индейцы. А поскольку среди животных и растений архипелага Ментавай высокий процент эндемизма, вполне возможно, что накапливающие метакват растения (грибы? насекомые?) встречаются только там.
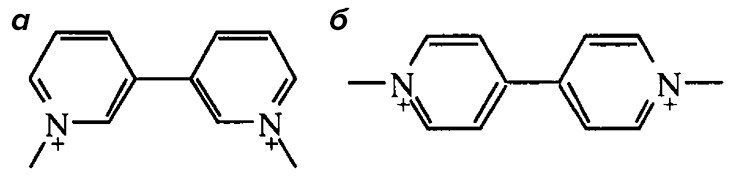
Рисунок 38а. Структурные формулы метаквата (а) и параквата (б)

Рисунок 38б. Охотник с островов Ментавай
На стыке наук
В этой статье уже многократно говорилось о том, что границы между биологией и химией постепенно стираются. Означает ли это, что в будущем эти науки утратят свои индивидуальные черты и сольются в одну? Есть все основания предполагать, что этого не произойдет. В свое время крупный русский эволюционист Феодосий Григорьевич Добржанский говорил, что в биологии всё имеет смысл только в свете эволюционного процесса. Наверное, именно в этом месте проходит грань между дисциплинами.
Когда были открыты вирусы, некоторое время велись жаркие споры, кем их считать. Простейшими живыми организмами? Или сложнейшими соединениями? Как и положено химическим веществам, вирусы имеют строгий состав, молекулярную массу, пространственную структуру и способны кристаллизоваться. Подобно живым существам, они размножаются, обладают наследственностью и изменчивостью. И именно по причине эволюционной изменчивости вирусы, в конце концов, все-таки отнесли к биологическим объектам. Химические вещества не эволюционируют. Мы a priori исходим из того, что четыре миллиарда лет назад, накануне возникновения жизни на Земле, вода и углекислый газ имели абсолютно те же свойства, что и в наши дни.
Тем не менее живые организмы постоянно «учатся» вырабатывать новые соединения. Это, конечно, мало касается так называемых первичных метаболитов — глюкозы, протеиногенных аминокислот и азотистых оснований ДНК и РНК. Эти вещества на редкость консервативны и представлены практически во всех без исключения живых клетках. А вот разнообразие вторичных метаболитов так же велико, как и самих биологических видов, если не больше. Далеко не все они открыты. Огромное их количество не будет открыто никогда, поскольку они «вымерли» вместе с выделявшими их когда-то организмами, и не оставили отпечатков. То есть химическое разнообразие биосферы никогда не будет охарактеризовано полностью.
Таким образом, химические вещества не эволюционируют. Но эволюционируют метаболические пути, поскольку находятся под контролем генома. Это позволяет из известных предшественников получать новые соединения. И они оказываются связанными генеалогическим родством с существовавшими ранее. Вот тут-то и проходит граница между дисциплинами. Здесь простираются владения биохимии — самой химической из биологических наук.
Метаболическая эволюция происходит буквально на наших глазах, порождая, например, огромное многообразие антибиотиков. Гонка вооружений не прощает остановок, поэтому именно биосинтез антибиотиков, пожалуй, эволюционирует с наибольшей скоростью. Некоторые из них получены в лабораториях при помощи генной инженерии, имитирующей естественный эволюционный процесс.
Но появление новых антибиотиков — это пример микроэволюционных изменений. Все-таки образуются вещества, близкие по составу и свойствам. Однако в долгосрочной перспективе эти мелкие изменения выходят на глобальный, макроэволюционный уровень. На мой взгляд, показательным примером является многообразие природных ароматических соединений, содержащих в своем составе бензольное кольцо. Многообразие действительно неисчислимое, я искал, но так и не нашел обзор, обобщающий (хотя бы поверхностно!) информацию о них. Но у них есть общая черта — большинство образуется из шикимовой кислоты. Не все, конечно: ароматические каротиноиды и поликетиды (например антибиотики группы тетрациклинов) формируются другими путями. Но большинство. Во всяком случае, общие предшественники — единственное, что объединяет такие непохожие друг на друга метаболиты, как гормон адреналин, рутин (витамин Р) и красный пигмент свёклы бетанин.
Будучи предшественником ароматических аминокислот (фенилаланина, тирозина, триптофана, п-аминобензойной кислоты), шикимовая кислота (рис. 39, слева вверху) образуется во многих живых организмах, но крайне редко накапливается до высоких концентраций. Один из немногих природных источников этого соединения — семена бадьяна (Illicium verum), произрастающего в субтропической Азии (рис. 39). В Японии это растение называют «сикими», отсюда и название кислоты.
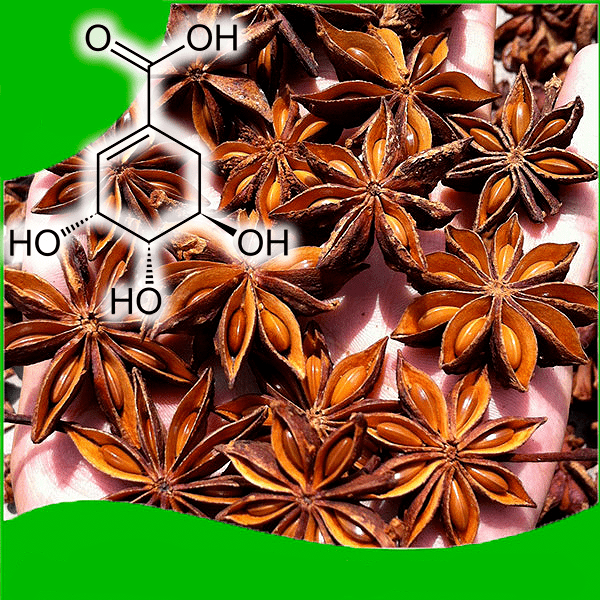
Рисунок 39. Плоды бадьяна — природного источника шикимовой кислоты. Шикимат (слева вверху) — биохимический предшественник большинства ароматических метаболитов.
Химики производят из шикимовой кислоты ряд лекарств, но наибольшее значение имеет вошедший во все учебники биохимии шикиматный путь биосинтеза ароматических соединений. Этот метаболический путь, без сомнения, очень древний. Его первые стадии, ведущие к ароматическим аминокислотам, вероятно, возникли еще на заре появления жизни и присутствуют у организмов практически всех таксономических групп. Правда, животные вторично утратили шикиматный путь, поэтому для человека фенилаланин и триптофан являются незаменимыми аминокислотами (тирозин — метаболит фенилаланина, и, в некотором смысле, является «условно незаменимой» аминокислотой).
А в ходе дальнейшей эволюции шикиматный путь оброс всевозможными «пристроями», каждый из которых уникален для узкой таксономической группы. Скажем, алкалоиды морфинанового ряда синтезируют из тирозина исключительно растения порядка лютикоцветных (Ranunculales), причем морфин встречается только в маковых (Papaveraceae) — одном из семейств этого порядка. В результате мы видим гигантское разнообразие метаболитов, зачастую служащих надежными маркерами таксономической принадлежности.
В самом деле, что общего между разноцветными пигментами растений, салициловой кислотой, пахнущим фекалиями скатóлом, компонентом древесины лигнином, переносчиком электронов убихиноном, гормоном щитовидной железы тироксином, душистым компонентом эфирных масел анетолом, ростостимулятором растений β-индолилуксусной кислотой, компонентом пищевой приправы куркумином, алкалоидом эфедрином, входящим в состав многих пептидов и большинства белков фенилаланином, антибиотиком левомицетином, обладающим терпким вкусом танином, витамином В9 (фолиевой кислотой), пигментом меланином из чернил каракатицы, красителем индиго, ядовитым дикумарином, специфическим метаболитом синегнойной палочки пиоцианином и выделенным из камеди ликвидамбара стиролом — мономером полистирола? Только то, что все они содержат бензольное кольцо. И все происходят из шикимовой кислоты (рис. 40 и 41).

Рисунок 40a. Этот скорпион, угодивший в луч ультрафиолетовой лампы, флуоресцирует зеленовато-голубым светом, поскольку в его кутикуле содержатся метаболиты ароматической природы. Слева внизу: 4-метилумбеллиферон, флуорофор кутикулы скорпиона.

Рисунок 40б. Контрастная окраска цветов ипомеи обусловлена содержанием в них разнообразных антоцианов.

Рисунок 40в. Ягуары разного окраса, обусловленного различным содержанием меланина в волосах. Слева: химическая структура эумеланина — пигмента волос млекопитающих.
Рисунок 41б. Схема биосинтеза антоцианов — небольшой фрагмент превращений аминокислоты тирозина в биосфере.
Рисунок 41б. Схема биосинтеза антоцианов — небольшой фрагмент превращений аминокислоты тирозина в биосфере.
А если учесть, что сама шикимовая кислота является одним из метаболитов глюкозы, то это означает, что шикиматный путь — фрагмент еще более древнего и всеобъемлющего метаболического пути углеродных соединений, в котором глюкоза — один из ключевых интермедиатов.
Из количества в качество

Рисунок 42. Этот спектрометр ЯМР с частотой 1,2 гигагерц сейчас является ультрасовременным. Прибор, без сомнения, открывает новые горизонты исследований веществ, в том числе и природных. Но долго ли он сможет сохранять свое первенство?
В своей замечательной научно-популярной монографии Александр Владимирович Марков назвал современную науку Временем великих Экспериментов. Пожалуй, еще никогда в истории поколения научной аппаратуры не сменяли друг друга так быстро (рис. 42). Каждый год приносит сенсационные открытия.
Естественно, рост возможностей приборов и обслуживающих их вычислительных машин приводит к расширению горизонтов Знания. Мы можем заглядывать все дальше и глубже в окружающий нас мир и видеть больше деталей. В частности, обнаруживать вещества в концентрациях, которые еще вчера были «ниже порога обнаружения». Новые экспериментальные данные накапливаются так быстро, что теоретики не успевают их обобщать. В результате, принятые научные теории на наших глазах устаревают, обрастают многочисленными исключениями и дополнениями. Однако тот же Марков предсказал, что на смену этой эпохе придет Время великих Теорий.
Совершенствование приборов рано или поздно упрется в естественные барьеры. Чтобы преодолеть их, понадобятся прорывные решения, но их придется ждать достаточно долго. Вот тогда-то и настанет время теоретиков. Вспоминается остроумное замечание, что сегодняшняя наука формирует залежи информации, которую завтра будем добывать и перерабатывать, как полезные ископаемые.
Конечно, нельзя заранее предсказать теории будущего. Но можно отследить тренд развития современной науки и предположить, что в недалеком будущем будут стираться грани между «естественным» и «искусственным». XIX и XX века прошли под эгидой четкого разграничения природы и культуры. И это наложило отпечаток на массовое сознание. Мы привыкли разделять биосферу и ноосферу, естественный и искусственный отборы, естественные и гуманитарные науки, природные и неприродные вещества. Вначале это служило предметом гордости — человек противопоставлял свою одухотворенность дикости и необузданности окружающего мира. Позднее, уже ближе к нашему времени, под тяжестью охватывающего цивилизацию кризиса настроения сменились на противоположные — мы стали проклинать собственную цивилизацию, призывать «вернуться к природе», восхищаться, как в природе все совершенно и продуманно, даже предсказывать сценарии скорого вымирания человечества.
Противопоставление «натурального» и «искусственного» (причем первое всегда несет положительную эмоциональную окраску) превратилось в мощные торговые бренды. Если население готово переплачивать за «экологичность», то почему бы не создать предложение?
Истина, конечно же, находится посередине. И теперь мы приходим к пониманию, что человек и созданная им культура — это биосферный феномен. Противопоставление цивилизации биосфере субъективно. Развитие нашей цивилизации отнюдь не находится в отрыве от законов природы. Игнорирование этого факта приводит к серьезным искажениям картины мира, выливающимся на практике в катастрофические социальные эксперименты, которыми изобиловал прошлый век. Наука недалекого будущего, формулируя новые концепции, неизбежно повлияет на массовое сознание. Будем надеяться, что это станет выходом из нынешнего кризиса.
Источник: БИОМОЛЕКУЛА