Целью работы, проведённой коллаборацией российских исследователей, было определение эффекта неабляционной (без удаления косного мозга реципиента) внутривенной трансплантации цельного молодого костного мозга (КМ) лабораторным животным - мышам чистой линии, пожилого возраста той же чистой линии, на максимальную продолжительность их жизни. Для этого трансплантация 100 миллионов ядерных клеток цельного КМ молодых доноров старому неаблированному животному была выполнена в то время, когда половина популяции уже умерла. В результате максимальная продолжительность жизни увеличилась на 28 ± 5%, а время выживания с начала эксперимента увеличилось в 2,8 ± 0,3 раза. Химеризм КМ через 6 месяцев после трансплантации составил 28%.
Увеличение максимальной продолжительности жизни является наиболее значимым показателем основных механизмов старения, в частности, в отношении возрастной потери стволовых клеток и накопления повреждений стволовых клеток. Самообновление тканей происходит непрерывно: таким образом, в сердце крыс около 7% клеток заменяется ежегодно, тогда как обновление крови и эпителиальных тканей происходит намного быстрее. Считается, что в обновлении тканей участвуют специальные резидентные стволовые клетки. Участие циркулирующих стволовых клеток в обновлении тканей мало изучено. Исследования in vitro показали, что при определенных условиях недифференцированные стволовые клетки могут эффективно дифференцироваться в тип клеток, к которым относится их клеточное микроокружение, что подтверждает возможность обновления тканей при внутривенном введении стволовых клеток (СК). Это может объяснить эффективное лечение путем трансплантации костного мозга не только заболеваний крови, но и системных заболеваний, таких как муковисцидоз, старческая потеря слуха и буллезный эпидермолиз, и др. Различные исследования ранее показали, что неабляционная трансплантация КМ замедляет старение.
Подход, применённый Российскими учёными, отличается от работ других исследователей сочетанием следующих параметров:
- большего количества пересаженного материала,
- тесной связи между донорами и реципиентами,
- отсутствием радиации и химиотерапии, токсичных для организма.
Трансплантация проводилась в возрасте, когда половина мышей уже умерла отстарости. К этому возрасту содержание СК в КМ падает более чем в 10 раз, изамещение трансплантированным материалом может происходить безмиелоабляционного кондиционирования реципиентов (удаление собственного костного мозга реципиентов). В настоящей работе, доноры КM были мыши линии B10-GFP и отличались от реципиентов только наличием трансгена зеленого флуоресцентного белка.
Первоначально в первой контрольной группе было 20 животных. Во второй опытной группе было 56 животных, пять из которых использовались для контроля уровня химеризма и были исключены из статистики смертности. Начиная с возраста 15 месяцев, когда около 50% мышей остаются живыми, экспериментальные животные получали серию внутривенных инъекций костного мозга от молодых доноров. Мышей в возрасте 3–15 недель и гетерозиготных по зеленому флуоресцентному белку той же линии B10-GFP использовали в качестве доноров КM.
В общей сложности 15–20 × 106 клеток на одно реципиентное животное медленно, в течение примерно 1 мин, инъецировали в объеме 200–300 мкл на животное инсулиновым шприцем (игла 0,33 × 12,7 мм) через хвостовую вену; хвост предварительно прогревали в течение 2–3 мин на водяной бане с температурой 44 ° С. Животное для инъекции помещали в пластиковую бутылку с хвостом, выходящим через перфорированную крышку, и поджимали во время проникновения иглы в вену; зажим был удален, когда игла была вставлена и инъекция началась. До 15 животных были пересажены в течение каждого дня трансплантации. Трансплантации повторялись 6 раз в течение 3 месяцев с 10–20-дневными интервалами. На рисунке 1 показано влияние сингенной трансплантации КМ молодых доноров на продолжительность жизни реципиентов.
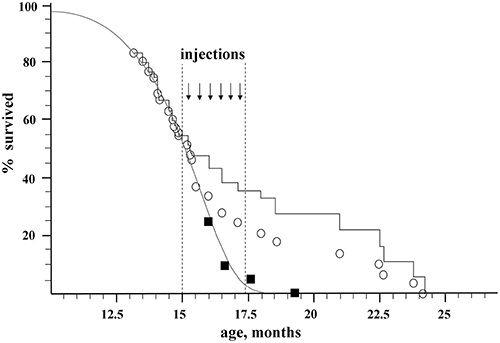
Рисунок 1. Влияние неабляционной трансплантации КM молодых доноров на популяционную динамику стареющих реципиентов. Открытые круги, экспериментальная группа; черные квадраты, контрольная группа; серая кривая, кривая Гомперца-Макема контрольной группы; черная ступенчатая кривая, экспериментальная группа с поправкой на эмболию (исключая эмболических животных).
Значительное (на 30%) увеличение максимальной продолжительности жизни мышей было обнаружено после неабляционной трансплантации 100 миллионов ядерных клеток костного мозга от молодых доноров, начатой в возрасте, эквивалентном 75годам для людей. Более того, омоложение сопровождалось высокой степеньюхимерности КМ для неабляционного подхода. Через шесть месяцев послетрансплантации 28% клеток КМ реципиентов были донорского происхождения. Для мониторинга уровня химерности (степени приживления донорских клеток) анализировали фракцию клеток GFP + в клеточном материале реципиента.
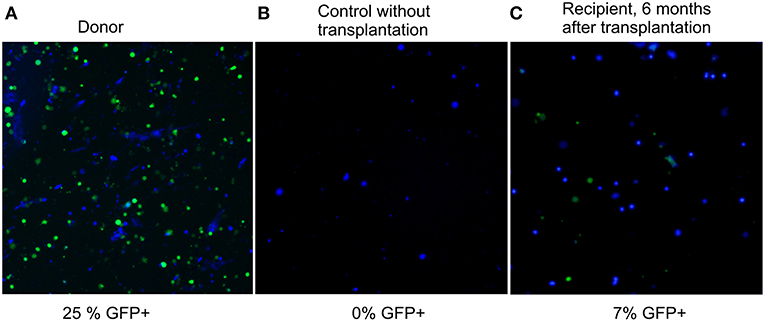
Рисунок 2. Флюоресцентные и фазово-контрастные фотографии тканей реципиентных мышей через 6 месяцев после трансплантации приведены в наложении.
Еть и другие причины, по которым неабляционная трансплантация предпочтительнее для старых реципиентов. Это меньший риск инфицирования и реакции «трансплантат против хозяина», угрожающий пациентам, в то время как отторжение трансплантата неаблифицированными реципиентами менее вероятно в пожилом возрасте, чем в более молодом возрасте из-за естественно более слабой иммунной системы в пожилом возрасте. Очевидно, что в пожилом возрасте иммунная система уже слишком пассивна, чтобы отвергать донорский КМ, но она все же эффективно подавляет инфекцию и реакцию «трансплантат против хозяина», что делает ненужным и нежелательным использование абляционного кондиционирования у пожилых людей.
Впервые омолаживающая терапия была начата так поздно, в тот момент, когда половина животных уже умерла, и было обнаружено высокое (31 ± 5%) увеличение максимальной продолжительности жизни остальных животных. Такое значительное влияние на максимальную продолжительность жизни, в отличие от средних колебаний продолжительности жизни, указывает на то, что трансплантация КМ влияет на внутренний механизм старения. Эффект продления жизни был значительно сильнее, чем в более ранних работах с аналогичным дизайном (без облучения или химиотерапии, без наследственных патологий у реципиентов, пожилого возраста в начале введения КМ) из-за большего количества пересаженного материала и тесная связь доноров и получателей.
Наблюдаемое увеличение продолжительности жизни сопровождалось продлением периода активной и здоровой жизни.
Химеризм костного мозга реципиентов после трансплантации КМ был значительным (28% ядросодержащих клеток КМ имели донорское происхождение) и постоянным (он длился не менее 6 месяцев после трансплантации), что указывает на то, что омоложение вызвано не только паракрином эффект, но и путем прямой замены клеток.
Источник: Frontiers in Genetics

