Внеклеточный матрикс (ВКМ) — многокомпонентная субстанция, в которую погружены все клетки нашего организма. В последнее десятилетие интерес к внеклеточному матриксу значительно возрос. Это связано с установлением его роли в старении, клеточной дифференцировке, успешной терапии рака и лечении некоторых наследственных заболеваний. Мы подготовили цикл статей, в котором расскажем об организации внеклеточного матрикса, болезнях, связанных с его патологиями, роли ВКМ в старении и подходах к корректировке возрастных изменений.
В первой статье цикла мы рассказываем о компонентах и функциях внеклеточного матрикса, разбираемся, какую практическую пользу может принести его изучение, а также вкратце освещаем самые важные открытия в этой области, совершенные за последний год.
ЧТО ТАКОЕ ВНЕКЛЕТОЧНЫЙ МАТРИКС?
Внеклеточный матрикс (ВКМ, extracellular matrix, ECM) объединяет разрозненные клетки в единый многоклеточный организм. ВКМ похож на государство, в котором живут граждане-клетки: он отвечает за благополучие клеток и управляет всеми аспектами их жизни — от питания и размножения до смерти. Для клеток ВКМ — это и квартира, и магазин, и интернет, и общественный транспорт.
ВКМ: основные игроки
Создатели ВКМ. Компоненты ВКМ синтезируют специализированные клетки. В соединительной ткани наиболее распространены фибробласты, однако создавать ВКМ умеют и другие клетки: в хрящах, например, это хондроциты, а в костях — остеобласты. Компоненты матрикса могут синтезировать и клетки прилегающих органов: например, клетки эпителия сосудов производят компоненты рыхлой соединительной ткани.
Разрушители ВКМ. Порядок в ВКМ наводят белки — разрушители его компонентов. Наиболее важные из них, металлопротеиназы, «расчищают путь» клеткам, которые движутся в ВКМ, и уничтожают старые и «сломанные» компоненты матрикса.
Основное вещество ВКМ. Основу матрикса формируют гиалуроновая кислота и особые белки: гликопротеины и протеогликаны (рис. 1). В состав ВКМ входит и множество других белков со специфической функциональной нагрузкой — интегрины, фибронектины, эластин, — о них мы поговорим в следующем разделе.
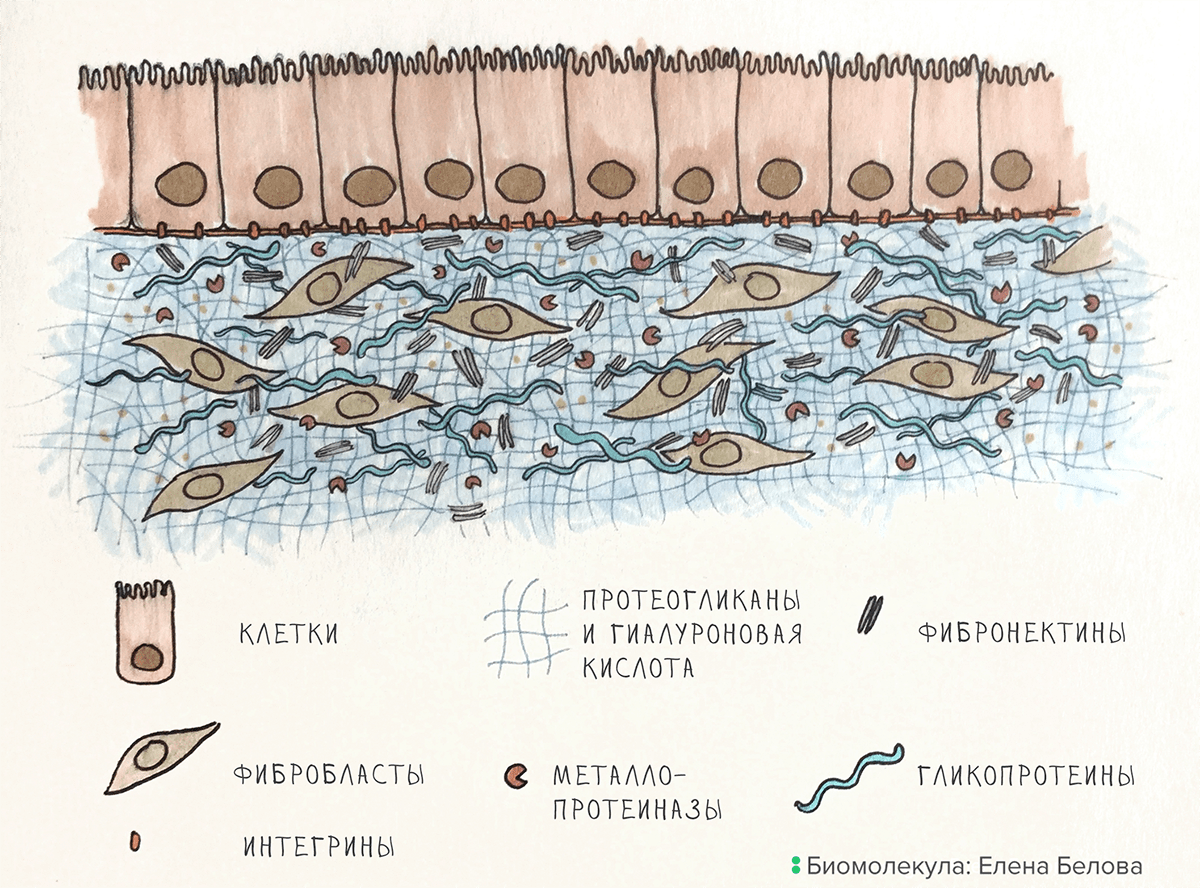 Рисунок 1. Организация ВКМ на примере кожи. Фибробласты создают ВКМ, металлопротеиназы его разрушают. Клетки эпидермиса связаны с ВКМ при помощи интегринов.
Рисунок 1. Организация ВКМ на примере кожи. Фибробласты создают ВКМ, металлопротеиназы его разрушают. Клетки эпидермиса связаны с ВКМ при помощи интегринов.
КОМПОНЕНТЫ ВКМ
Выделяют два подкласса белков, содержащих углеводы, — протеогликаны и гликопротеины. Оба подкласса входят в состав ВКМ, однако между ними есть существенные различия.
В гликопротеинах доля углеводов не превышает 20%, углеводные цепи короткие, имеют нерегулярное строение и не содержат уроновых кислот.
К гликопротеинам относятся такие важные структурные белки, как коллаген и эластин. За счет самого распространенного структурного белка в организме — коллагена — ВКМ приобретает прочность, а за счет эластина — гибкость и эластичность.
Протеогликаны — сложные белки с высокой степенью гликозилирования, часто имеющие в своем составе уроновые кислоты. В отличие от гликопротеинов, около 90–95% массы такой молекулы составляют длинные углеводные цепи регулярного строения, а на белки приходится лишь 5–10%. Такое строение обуславливает высокую молекулярную массу протеогликанов. Например, у аггрекана, белка хрящевой ткани, она может достигать 5 МДа! Протеогликаны запасают воду и полезные вещества, то есть работают как «магазин», из которого клетки получают необходимые «продукты». Например, они могут фиксировать ионы кальция в очагах оссификации. Кроме того, они играют роль межтканевых прослоек и смазочного материала в суставах.
Интегрины — трансмембранные клеточные рецепторы, которые взаимодействуют с ВКМ и участвуют в межклеточной коммуникации. В результате этих взаимодействий в клетках активируются сигнальные каскады, регулирующие экспрессию генов, отвечающие за пролиферацию и дифференцировку клеток, их выживание или апоптоз. То есть система интегрины—ВКМ — нечто среднее между «интернетом» и «рабочим чатом».
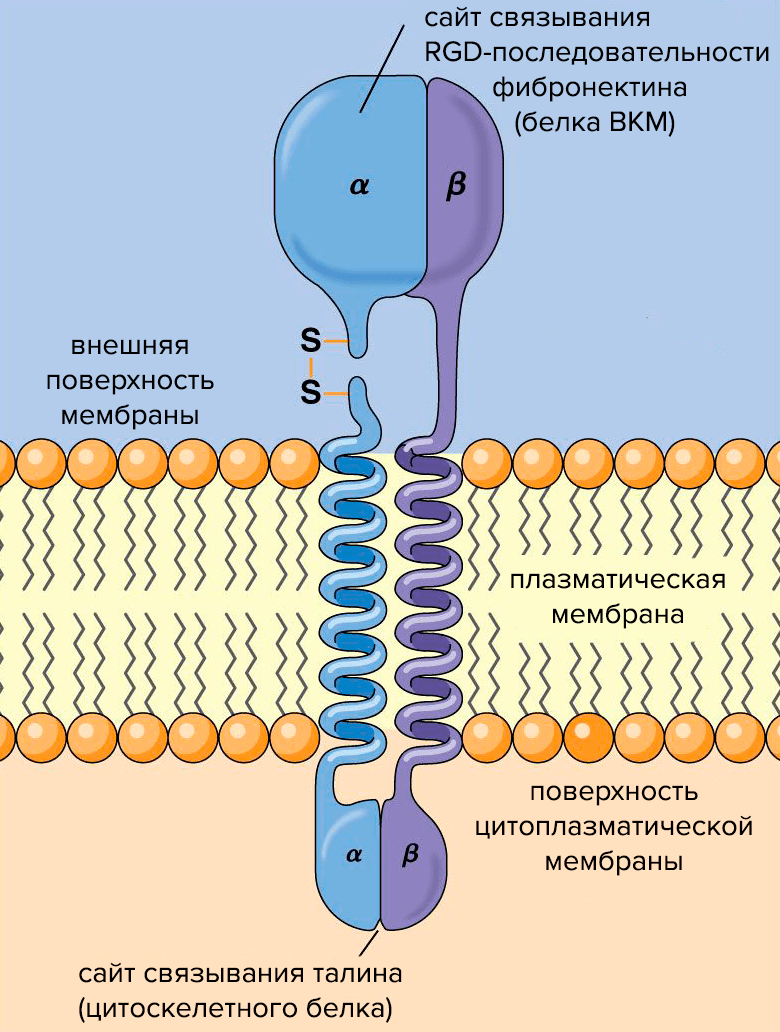
Рисунок 2. Схема строения молекулы интегрина. Субъединицы интегрина (α и β) пронизывают плазматическую мембрану, связывая клетку с внешней средой.
Структурно интегрины представляют собой облигатные гетеродимеры: каждый состоит из одной α- и одной β-субъединицы (рис. 2). Альфа-субъединицы определяют специфичность интегрина к лиганду — молекуле, способной образовывать комплекс с интегрином и таким образом воздействовать на клетку. Бета-субъединицы связаны с компонентами цитоскелета и обеспечивают передачу сигнала в клетке.
Интегрины улавливают химические и физические сигналы из внеклеточного матрикса и проводят их в клетку. Сигнал от интегринов передается в ядро через белки цитоскелета и сигнальные белки — так ВКМ управляет экспрессией генов и регулирует клеточную пролиферацию. При посредничестве белков цитоскелета ВКМ также управляет формой и движениями клеток.
Фибронектины — это белки клеточной адгезии. Растворимые предшественники фибронектинов синтезируюся внутри клеток и затем попадают в ВКМ. Интегрины превращают фибронектины в нерастворимые нити — компоненты внеклеточного матрикса. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ.
Гиалуроновая кислота (ГК) синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. По составу ГК похожа на углеводную часть протеогликана и представляет собой полимер из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и, подобно фибронектину, дает клеткам возможность закрепляться на различных поверхностях. Образно говоря, ГК выполняет задачи «интернет-провайдера» и «билета на общественный транспорт».
ПОЧЕМУ ТАК ВАЖНО ИЗУЧАТЬ ВНЕКЛЕТОЧНЫЙ МАТРИКС?
Внеклеточный матрикс присутствует во всех тканях организма, поэтому сбои в его функционировании ведут к развитию болезней соединительной ткани, преждевременному старению и гибели клеток. Самый очевидный стимул для изучения ВКМ — необходимость лечения заболеваний, связанных с нарушениями структуры соединительной ткани. Таких болезней много, они могут протекать тяжело и значительно ухудшать качество жизни пациентов. Вот несколько примеров.
Мутации в генах, отвечающих за синтез структурных белков ВКМ, приводят к врожденным патологиям. Поскольку соединительная ткань — основа всех систем организма, пострадать от генетических нарушений может любой орган. Такие нарушения приводят:
- на уровне костей — к несовершенному остеогенезу,
- на уровне кожи — к синдрому Элерса—Данлоса, при котором кожа становится слишком эластичной,
- на уровне мышечной ткани — к врожденной мышечной дистрофии (CMD).
Из всех типов генетических нарушений ВКМ лучше всего изучена врожденная миодистрофия. Это заболевание развивается из-за нескольких мутаций, нарушающих работу мышц. В результате мутации в гене ITGA7, кодирующем интегрины мышечных клеток, нарушается связь клеток с ВКМ. Это гибельно для мышечной ткани: потеря связей с ВКМ запускает апоптоз — программируемую смерть клеток.
Преждевременное разрушение ВКМ — еще одна серьезная проблема. Здоровый внеклеточный матрикс постоянно обновляется и реструктурируется. За это отвечает семейство металлопротеиназ, белков — разрушителей ВКМ.
Металлопротеиназы — ферменты, в каталитический центр которых входят ионы металлов, в основном цинка. Отсюда и название с приставкой «металло-». Помимо каталитического центра, который отвечает за разрушение ВКМ, у металлопротеиназ есть регуляторный продомен, оберегающий фермент от преждевременной активации и ложного срабатывания.
Сейчас же нам важно понять, что если металлопротеиназы «выходят из-под контроля», то они начинают буквально сметать всё на своем пути. Бесконтрольное разрушение ВКМ приводит к фиброзу и может вызвать рак — например, рак предстательной железы.
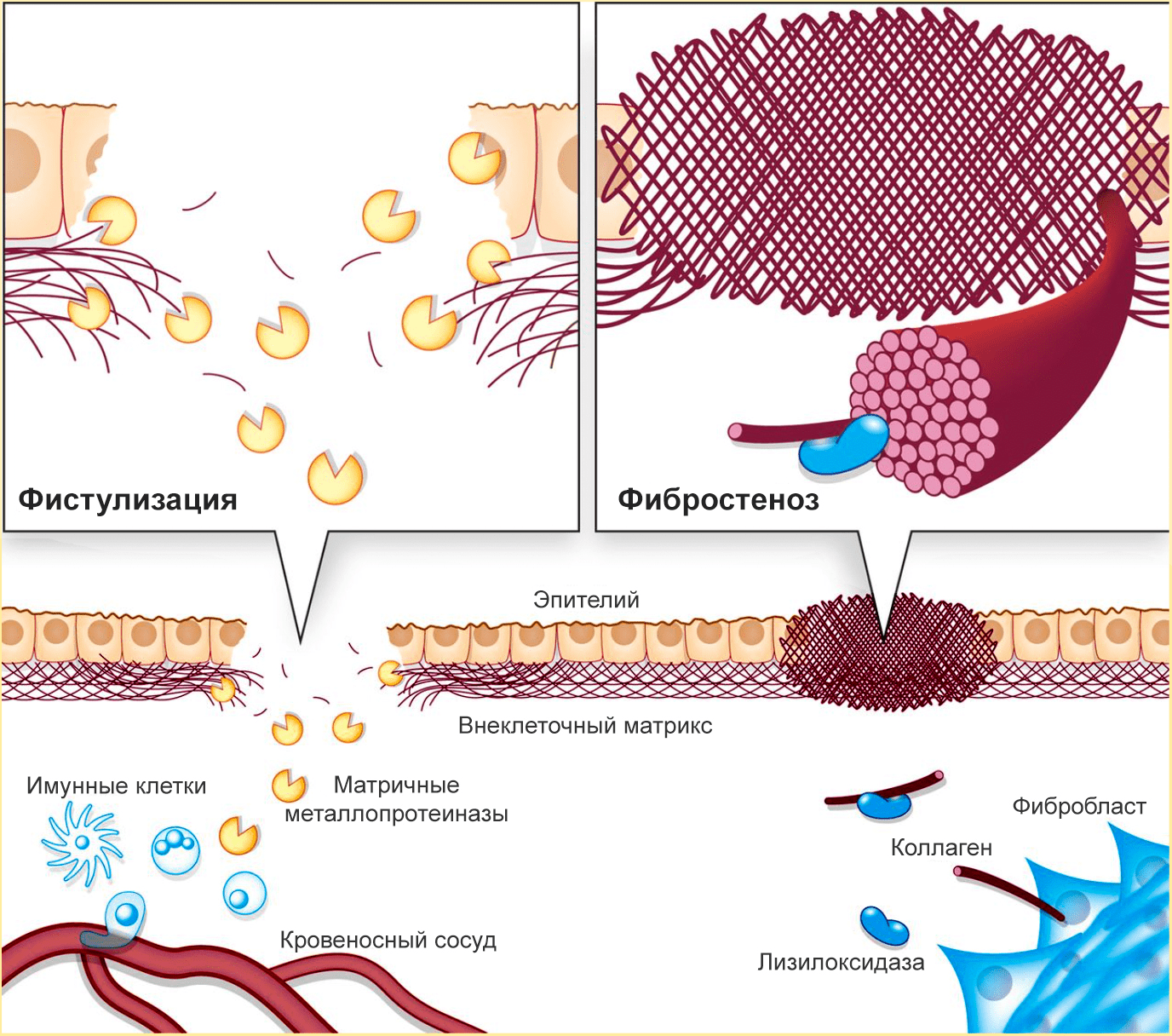
Еще одна патология, вызываемая нарушениями в процессах разрушения и формирования ВКМ, — болезнь Крона (хроническое воспаление кишечника). По мере ее развития возникает фистулизация и фибростеноз кишечника (рис. 3).
Рисунок 3. При болезни Крона происходит фистулизация и фибростеноз кишечника. Из-за избыточного разрушения ВКМ в кишечной стенке образуются отверстия, а из-за избыточного синтеза коллагена сужается просвет кишечника.
Фистулизация — образование отверстий в кишечной стенке. Этот процесс связан с неконтролируемой активностью металлопротеиназ, разрушающих коллаген слизистой оболочки кишечника. Так как целостность слизистой нарушается, иммунные клетки из кровеносных сосудов проникают в кишечную стенку — так развивается воспаление, а через некоторое время появляется отверстие в стенке кишечника.
Фибростеноз — сужение кишечника. Реагируя на повреждения, фибробласты интенсивно производят коллаген. Затем активируется лизилоксидаза — внеклеточный медьсодержащий фермент, катализирующий образование сложных поперечный связей в коллагене и эластине. Лизиолоксидаза необходима для формирования зрелых коллагеновых волокон, но при ее избытке начинаются проблемы. Этот фермент создает прочную коллагеновую сеть, «запечатывающую» поврежденные кишечные стенки, но из-за избыточной жесткости коллагеновых «печатей» фиброз только усиливается. В результате возникают воспаление и (иногда) непроходимость кишечника. Фистулизация усиливает фибростеноз: неуправляемое разрушение коллагена стимулирует его столь же неуправляемый синтез.
Избыточный синтез ВКМ часто говорит о том, что у человека рак и у этого рака плохой прогноз. Кроме того, сам ВКМ может способствовать росту опухоли и распространению метастазов — это доказано для опухоли головного мозга. Особенно неприятно, что существующие методы лечения — например, лучевая терапия — способны заставить ВКМ послать клеткам сигнал, который может привести к рецидиву опухоли мозга.
Состав ВКМ головного мозга уникален: в нём очень много гиалуроновой кислоты и при этом гораздо меньше коллагена, фибронектина и других компонентов, характерных для ВКМ всех остальных тканей. Несмотря на важность ГК для нормальной работы тканей, в некоторых случаях она помогает проводить в клетки опухоли сигналы, делающие их более агрессивными.
Лучевая терапия стимулирует работу мембранных белков HAS2, которые отвечают за синтез ГК. В результате они синтезируют больше гиалуроновой кислоты, а чем больше ГК, тем агрессивнее становятся опухолевые клетки. Получается, что лучевая терапия может стимулировать метастазирование опухоли. Таким образом, из-за особенностей ВКМ лучевая терапия помогает только на время: опухоль часто возвращается, становясь еще более опасной. Отчасти по этой причине некоторые виды опухолей мозга так плохо поддаются лечению.
Проблемы с ВКМ — важная причина старения
Первые признаки старения, которые сразу бросаются в глаза, — слабость, хрупкость костей, появление морщин и старческих пятен. Многие из этих проблем связаны с необратимыми изменениями во внеклеточном матриксе.
Одна из причин старения кожи — нарушение работы фибробластов (клеток, синтезирующих компоненты внеклеточного матрикса). При этом благополучие фибробластов зависит от состояния внеклеточного матрикса — получается замкнутый круг.
Рисунок 4. Микрофотография коллагеновых нитей в коже. а — «Целый» коллаген в молодой коже. б — Фрагментированный коллаген в стареющей коже. Стрелки указывают на старые, «разорванные» на кусочки нити коллагена.
Чтобы фибробласты хорошо себя чувствовали, им нужно цепляться за интактные, целые коллагеновые нити. Но со временем эти нити фрагментируются, и фибробластам становится не к чему крепиться, чтобы создать новый, целый коллаген (рис. 4). Если бы мы научились разрывать этот замкнутый круг, то нам, вполне возможно, больше никогда не понадобились бы антивозрастные услуги косметологов и пластических хирургов.
Старение костной ткани чаще всего связано с нарушением работы остеобластов. Эти клетки создают костный ВКМ, синтезируя коллаген и особые гликопротеины, которые участвуют в первом этапе минерализации коллагена. На втором этапе коллаген превращается в прочный внеклеточный матрикс — основу кости.
С течением лет старые остеобласты погибают, а новые делятся хуже и хуже. Оставшимся в живых стареющим клеткам становится всё сложнее справляться с созданием внеклеточного матрикса. Из-за этого кости у пожилых людей становятся очень хрупкими и плохо заживают после переломов.
Если бы мы могли заставить остеобласты делиться или хотя бы выяснили, как помочь им эффективнее минерализовать соединительную ткань, у пожилых людей появилась бы возмножность быстрее восстанавливаться после переломов. Такие работы уже ведутся!
В одной из подобных работ исследователи взяли коллагеновый гель, добавили к нему два неколлагеновых белка, ответственных за минерализацию коллагена (остеокальцин и остеопонтин), и создали на их основе искусственный внеклеточный матрикс. Этот исусственный ВКМ исследователи «предложили» остеобластам, полученным из стволовых клеток костного мозга. В результате активизировалось деление остеобластов, и эти остеобласты начали производить больше компонентов внеклеточного матрикса — правда, пока только в лабораторных условиях. Чтобы искусственный ВКМ появился в кабинете травматолога и оказал содействие в восстановлении костей реальных пациентов, потребуется провести еще много исследований.
ЧТО НОВОГО МЫ УЗНАЛИ О ВНЕКЛЕТОЧНОМ МАТРИКСЕ ЗА ПОСЛЕДНИЙ ГОД?
Над изучением ВКМ работают сотни исследовательских групп по всему миру, и каждый день появляется множество публикаций по этой теме. Давайте рассмотрим несколько свежих работ, чтобы получить представление о ключевых направлениях современных исследований. Вот что мы узнали о компонентах ВКМ в 2018 году.
Металлопротеиназы
Когда металлопротеиназы преждевременно разрушают эластин и коллаген легких, возникает соединительнотканное заболевание легких — эмфизема. Ученые давно стремились узнать, какой генетический компонент влияет на чрезмерную активность металлопротеиназ при этом заболевании.
Исследователи из немецкого Общества имени Макса Планка связали чрезмерную активность металлопротеиназ в легких со снижением активности гена Myh10. Если этот ген «отключали» в мышиных легких, их внеклеточный матрикс формировался неправильно, разрушались межальвеолярные перегородки, с укрупнением альвеол сокращалась суммарная площадь их поверхности, а значит, должен был страдать газообмен. То есть события развивались по сценарию, типичному для человеческой эмфиземы лёгких. Кроме того, авторы работы выявили снижение экспрессии гена MYH10 в легких людей, страдающих эмфиземой.
Не исключено, что в будущем мы научимся управлять процессами, которые протекают в матриксе, используя редактирование генома и генную терапию.
Гликопротеины и металлопротеиназы
Яркий пример коварства металлопротеиназ — образование аневризм. Так, при аневризме брюшной аорты матриксные металлопротеиназы разрушают компоненты, из которых строится ВКМ этого крупного сосуда. Вскоре эта область воспаляется благодаря деятельности иммунных клеток — макрофагов. Механизмы, заставляющие металлопротеиназу разрушать аорту, долгое время оставались неизвестными.
Американским исследователям удалось выяснить, что макрофаги синтезируют нетрин-1 — белок, активирующий клетки гладких мышц сосудов. Под воздействием нетрина-1 гладкомышечные клетки активируют свободные металлопротеиназы, разрушающие соединительную ткань сосуда.
Возможно, когда-нибудь мы научимся использовать иммунные клетки, чтобы управлять разрушением внеклеточного матрикса.
Интегрины и фибронектины
Южноафриканские исследователи обнаружили, что на синтез и деградацию фибронектина влияет внутриклеточный белок теплового шока Hsp90. Этот белок воздействует на фибронектин посредством рецептора LRP1. Если заблокировать этот рецептор, количество фибронектина, который накапливается во внеклеточном матриксе, уменьшается. И это очень хорошо — ведь из-за избыточного накопления фибронектина развиваются многие патологии ВКМ.
Не исключено, что если мы обнаружим подобные рецепторы в клетках разных тканей и научимся на них воздействовать, то сможем предотвращать болезни, связанные с накоплением ВКМ — например, фиброз легких.
Гиалуроновая кислота
Как компонент внеклеточного матрикса гиалуроновая кислота участвует в передаче сигнала от ВКМ в клетку и даже может превратить здоровую клетку в злокачественную. Гиалуроновая кислота воздействует на клетки через рецептор CD44.
Удалось выяснить, что интенсивность сигнала, запускающего злокачественный процесс в клетке и определяющего, насколько опасна будет получившаяся раковая клетка, зависит от концентрации гиалуроновой кислоты и от ее молекулярной массы.
Гиалуроновая кислота управляет раковыми клетками, связываясь с трансмембранным белком — интегрином CD44. Активация рецептора CD44 подавляет апоптоз, из-за чего клетка становится «бессмертной», то есть раковой. Чем больше гиалуроновой кислоты, тем больше активируется рецепторов CD44 и тем, соответственно, опаснее и агрессивнее будут раковые клетки.
Если мы научимся управлять гиалуронидазами — ферментами, которые отвечают за модификацию и деградацию гиалуроновой кислоты, — мы сможем предотвращать развитие рака и появление метастазов.
Как создавать ВКМ
Когда мы усовершенствуем технологии создания искусственного ВКМ, мы сможем производить полноценные ткани и использовать их в регенеративной медицине. Работы в этом направлении ведутся уже давно, и в прошлом году удалось сделать несколько важных шагов на пути к технологии искусственного ВКМ.
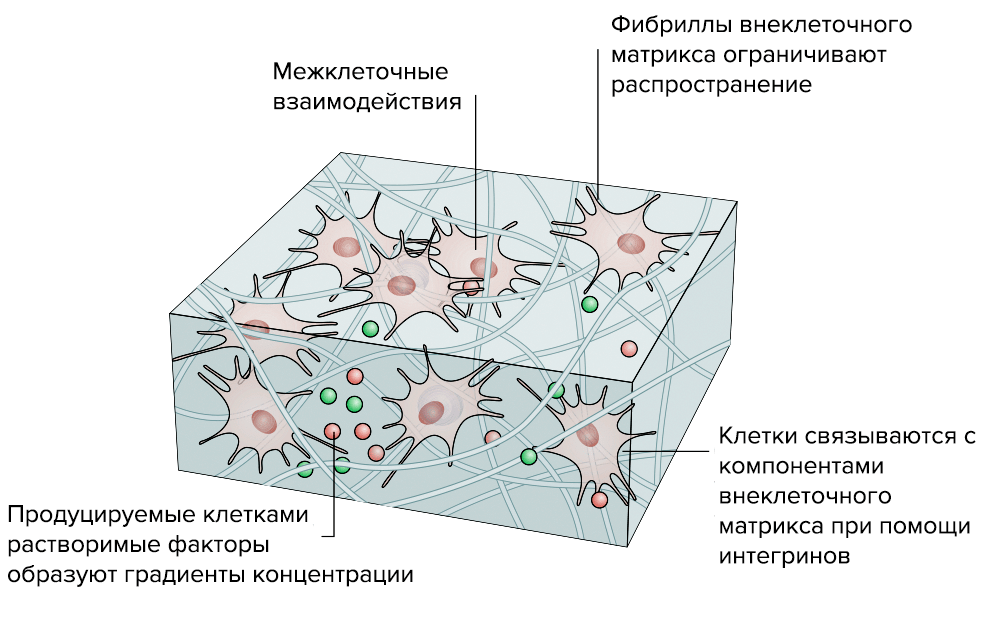
Исследователи уже научились создавать рабочие 3D-модели ВКМ (рис. 5). В отличие от традиционных 2D-моделей, которые, по сути, представляли собой клеточную культуру в чашке Петри, 3D-модели позволяют создать работающий объемный «макет» нужной нам ткани.
Рисунок 5. Преимущества «объемной» 3D-модели соединительной ткани перед стандартной «плоской» 2D-моделью. 3D-модель. «Живой макет» ведет себя почти так же, как функциональная ткань: клетки растут и располагаются так, как им «нравится», поэтому у них сохраняется способность к полноценному межклеточному взаимодействию.
3D-модели можно модифицировать и дорабатывать. Уже созданы первые гидрогели — биосовместимые синтетические полимеры, способные удерживать воду. С появлением гидрогелей появилась и теоретическая возможность печатать внутренние органы.
Перед тем как первые напечатанные в лаборатории 3D-органы поступят в больницу, ученым придется решить еще множество проблем. Например, исследователям только предстоит разобраться с тем, как «подвести» к искусственным органам кровеносные сосуды. В этом тоже может помочь понимание биологии ВКМ — ведь мы уже знаем, что внеклеточный матрикс управляет в том числе и ростом сосудов.
Заключение
Внеклеточный матрикс — огромная тема, которую очень сложно охватить в одной статье. Ясно одно: если мы сумеем разобраться, как ВКМ функционирует и влияет на клетки, медицина сделает огромный шаг вперед.
Новые открытия в области изучения ВКМ помогут нам:
- победить опасные наследственные болезни,
- эффективно бороться с некоторыми видами рака,
- создавать искусственные органы и ткани,
- возвращать людям молодость и красоту.
Судя по всему, ждать прорыва в изучении ВКМ осталось недолго.
Источник: БИОМОЛЕКУЛА