В начале марта 2019 года публикация в журнале Science Translational Medicine сообщила о том, что ученым удалось успешно применить CAR T-клеточную терапию для лечения системной красной волчанки в мышиной модели заболевания. Как работает новое лечение и что это значит для пациентов с системной красной волчанкой?

«Бабочка» из сыпи на переносице и щеках стала негласным символом системной красной волчанки
Многие аутоиммунные заболевания не так давно были смертельным приговором, а сегодня их если не излечивают, то значительно повышают качество жизни пациентов. В случае системной красной волчанки (СКВ) препараты — обычно это иммунодепрессанты, кортикостероиды и гидроксихлорохин — помогают облегчить изнуряющую симптоматику болезни. Однако они и сами обладают множеством побочных эффектов, которые в свою очередь могут угрожать здоровью пациента. Более того, химерное моноклональное антитело ритуксимаб, считавшееся самой перспективной разработкой, «провалилось» в двух ключевых клинических исследованиях: EXPLORER и LUNAR.
Поэтому новая работа о том, что уже одобренная терапия рака крови успешно была протестирована на животных в модели СКВ, — действительно важная новость для нескольких миллионов пациентов с этой болезнью.
Согласно Lupus Foundation of America, в мире на долю пациентов с СКВ приходится 70% от страдающих всеми формами волчанки, что, по минимальным оценкам, составляет 3,5 миллиона человек.
Что такое системная красная волчанка?
Системная красная волчанка — это аутоиммунное заболевание, при котором в организме человека (за редким исключением) присутствуют аутоантитела, нацеленные на собственные клетки. Главную роль отводят В-лимфоцитам: они опознают различные фрагменты клеток организма как чужеродные и презентируют их Т-лимфоцитам, вырабатывают антинуклеарные антитела, а вдобавок и производят провоспалительные цитокины. Образующиеся иммунные комплексы осаждаются и вызывают повреждения органов.
СКВ — очень сложное и зачастую агрессивное заболевание. Из-за многообразия симптомов его бывает трудно диагностировать, и до конца не ясно, что именно вызывает его развитие. Но сейчас исследователи уже выявили некоторые факторы, которые этому способствуют, и среди них есть и генетическая предрасположенность, и воздействие агрессивных факторов среды.
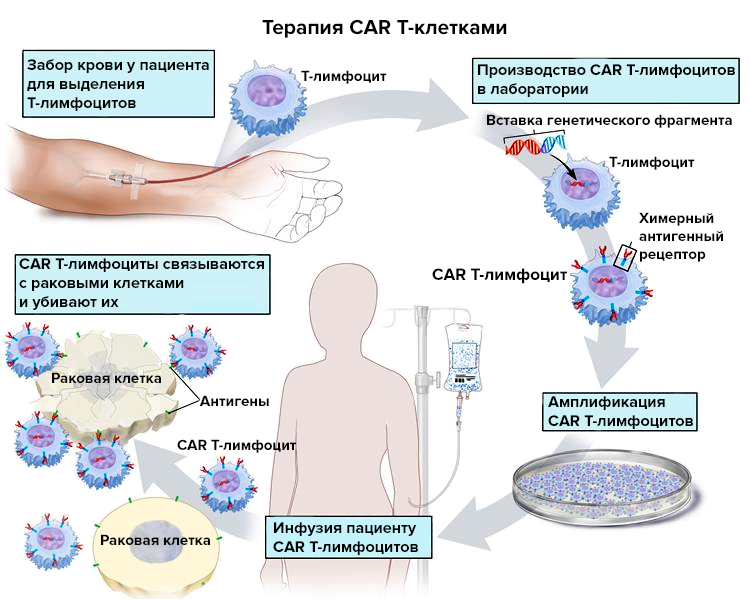
Тестируемое лекарство относится к CAR Т-клеточной терапии. Геном собственных Т-лимфоцитов пациента, выделенных из организма, модифицируют, и клетки, амплифицированные в лаборатории и перенесенные обратно пациенту, начинают экспрессировать химерный антигенный рецептор (chimeric antigen receptor, CAR) (рис. 1). Отсюда и пошло название терапии: CAR T cell.
Рисунок 1. Общий принцип получения CAR T-лимфоцитов
В простейшем случае CAR состоит из:
- внеклеточного домена (чаще всего это scFv — single-chain variable fragment), позволяющего Т-лимфоциту распознать специфический антиген;
- трансмембранного домена;
- внутриклеточного домена (обычно это CD3ζ-цепь Т-клеточного рецептора), стимулирующего иммунную клетку.
В итоге «улучшенные» Т-лимфоциты убивают только те клетки, на которые их нацелили.
Исследователи научились также использовать различные «надстройки» на эту структуру и усиливать эффективность противоопухолевого лечения, для которого CAR T-клеточная терапия и применяется. Так, например, CAR T-клетки могут нести дополнительные костимулирующие внутриклеточные домены или секретировать провоспалительные цитокины.
Важно отметить, что терапия обладает довольно сильными побочными эффектами, которые даже могут угрожать жизни пациентов. Однако, к счастью, в подавляющем большинстве случаев их научились купировать.
CAR T-клеточная терапия для лечения рака
CAR T-клеточная терапия, нацеленная на CD19+ В-лимфоциты, оказалась очень успешной в лечении раков крови. В 2017 году FDA (Управление по контролю за продуктами и лекарствами США) одобрило две CAR T-клеточные терапии: Kymriah от Novartis Pharmaceuticals и Yescarta от Kite Pharma, которую в свою очередь купила Gilead Sciences.
Первый пациент, получивший терапию Kymriah, — девочка Эмили — уже девять лет живет без рака. Доктор Карл Джун же, который руководил процессом ее лечения, попал в список 100 самых влиятельных людей мира на 2018 год, по мнению журнала Times.
Государства стараются дать доступ своим гражданам к прорывному лечению. Например, это уже реализовала Национальная служба здравоохранения Великобритании: первый пациент получил лекарство «Новартиса» за счет государства в январе 2019 года.
Многие лаборатории пытаются наладить применение CAR T-клеточной терапии и для солидных раков, однако эта задача намного сложнее из-за специфики подобных опухолей. Тем не менее даже в этой области намечается некий прогресс.
Поскольку В-лимфоциты играют важную роль не только при заболеваниях крови, но и в аутоиммунных заболеваниях, неудивительно, что нацеленная CAR Т-клеточная терапия вызвала интерес у исследователей, занимающихся СКВ.
Группа под руководством Марко Радича провела тестирование CD8+ Т-лимфоцитов с химерным антигенным рецептором, нацеленным на CD19, — ту же самую молекулу, на которую нацеливают одобренную FDA терапию рака крови. Работа была проведена на моделях (NZB × NZW) F1 и MRLfas/fas СКВ.
Модифицированные CAR Т-лимфоциты были введены 41 животному. У 26 мышей терапия успешно уничтожила практически все В-лимфоциты, несущие CD19, и, соответственно, устранила производство аутоантител. Признаки болезни исчезли из селезенки, кожи, почек.
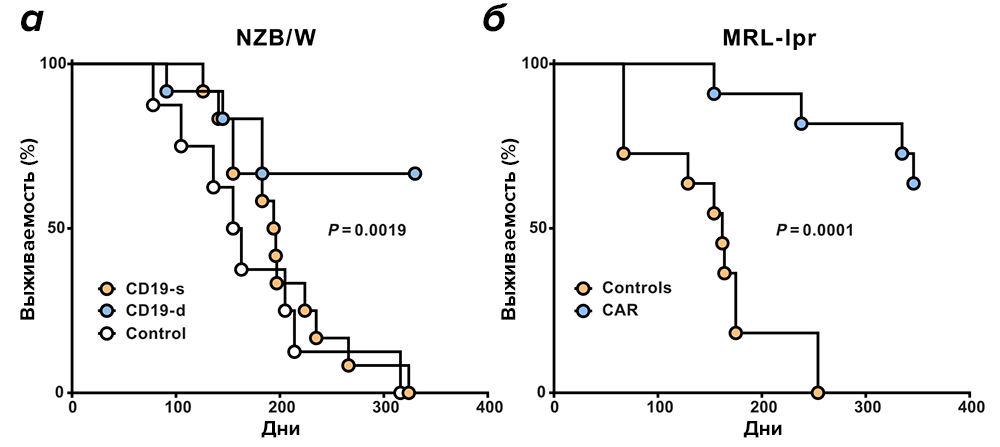
CAR Т-лимфоциты были активны как минимум в течение одного года in vivo. Большинство пролеченных животных прожили более года после переноса CAR Т-лимфоцитов, что, по мышиным меркам в данном контексте, очень много. Те же, кто были в контрольной группе и получали плацебо, прожили максимум 8–10 месяцев (рис. 2). Пока не ясно, почему для 15 животных терапия не сработала.
Рисунок 2. Влияние CAR Т-клеточной терапии, нацеленной на CD19, на выживаемость в мышиных моделях системной красной волчанки. а — Кривые выживаемости мышей NZB/W после инфузии CAR Т-лимфоцитов в животных семимесячного возраста. Выживаемость мышей CD19-d (CD19+ B cell depleted, n = 12) сравнивали относительно мышей CD19-s (CD19 sufficient, n = 12). Для сравнения показана выживаемость контрольных мышей (n = 8). б — Кривые выживаемости мышей MRL-lpr из опытной и контрольной групп. Мышей, получивших CAR T-лимфоциты, (n = 11), сравнивали с контрольными мышами MRL-lpr (n = 11).
Остается и самый важный вопрос: а как соотнести эти результаты с потенциальным применением терапии у людей?
С одной стороны, животных активно и успешно используют в изучении СКВ. У некоторых линий мышей, например, New Zealand, MRL и BXSB, спонтанно развивается аутоиммунный синдром, напоминающий человеческую болезнь. Кроме того, манипуляции с мышиным геномом помогли выявить гены предрасположенности к развитию волчанки, среди которых оказались те, что участвуют в регуляции апоптоза и сигналинге через рецепторы В-лимфоцитов.
С другой стороны, пока что новое исследование находится на доклинической стадии, и ему предстоит еще много проверок. Как показал опыт с ритуксимабом, о котором шла речь выше, даже при успешном тестирования на ранних стадиях разочарование может ждать в окончательных клинических испытаниях. Однако важно отметить, что моноклональное антитело было нацелено на CD20, а не на CD19, и, возможно, требовало присутствия макрофагов, функция которых может быть изменена при СКВ. CAR T-клеточная терапия же работает с В-лимфоцитами «напрямую».
Не все ученые настроены столь позитивно. Например, Лоуренс Морель, иммунолог из Университета Флориды, не принимавший участия в работе, напоминает, что уже многие препараты показывали свою успешность в мышиных моделях, но при этом пока ни один не дошел до продажи на рынке. «Это [новая публикация] должно заставить нас задуматься о новых подходах, которые можно использовать, но все же это только экспериментальное исследование», — говорит Морель и пессимистично добавляет, что в ближайшее время CAR T-терапия не вылечит никого из пациентов с системной красной волчанкой.
Что ж, в любом случае новая публикация показала: провал ритуксимаба не означает того, что нужно бросать попытки нацеливания лекарств на В-лимфоциты, и, возможно, исследователи уже на пути к разработке терапии, работающей у людей.
Источник: БИОМОЛЕКУЛА