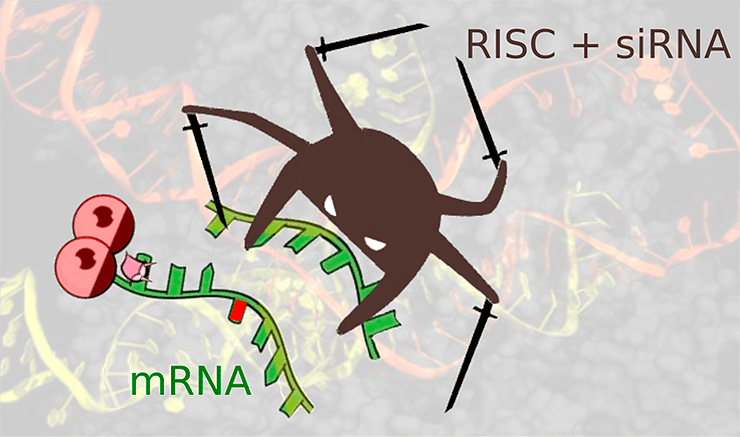
Подавление экспрессии мутантного гена TTR, вызывающего семейную амилоидную полинейропатию: РНК-индуцируемый комплекс выключения гена (RISC) совместно с интерферирующей РНК (siRNA) бесстрашно летит навстречу злобной патогенной мРНК-мишени, предвкушая расправу.
Патисиран — первый препарат на основе РНК-интерференции, одобренный FDA, — не только спасает жизни людей, страдающих амилоидной полинейропатией. Он начинает писать новую страницу в терапии, о которой мечтали с момента открытия этого механизма подавления экспрессии генов, то есть уже более 20 лет. С какими сложностями сталкивались ученые и как их преодолели? Об этом вы можете узнать в этой статье.
Амилоиды в первую очередь ассоциируются с болезнью Альцгеймера. Однако амилоидозы — это целая группа заболеваний, связанная с неправильным сворачиванием белка, приводящим к накоплению в тканях нерастворимых фибрилл.
Семейная амилоидная полинейропатия (FAP), или наследственный транстиретиновый амилоидоз (hATTR), связана с различными точечными мутациями в гене, кодирующем транстиретин (TTR). В норме он вырабатывается гепатоцитами и осуществляет транспорт витамина А вместе с тиреоидными гормонами к периферическим тканям. Определенные мутации способствуют тому, что мономеры этого белка неправильно сворачиваются и образуют аморфные олигомеры, которые сливаются в фибриллы (рис. 1). По некоторым данным, именно небольшие олигомеры обладают наибольшей токсичностью в клетках.
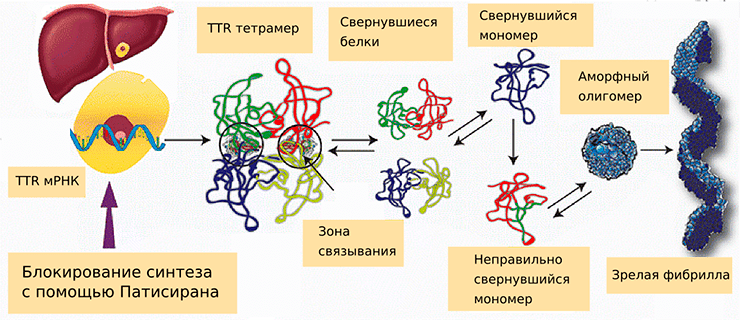
Рисунок 1. Синтез мутантного варианта транстиретина и влияние на этот процесс патисирана. Без лечения мРНК TTR транслируется в белок, который в норме состоит из четырех субъединиц. Мутантные мономеры белка сворачиваются неправильным образом и образуют аморфные олигомеры, кластеры нефиксированного размера, сливающиеся в фибриллы. Образование фибрилл может привести к развитию нейродегенеративных заболеваний и проблемам с сердечно-сосудистой системой.
На начальных стадиях заболевания фибриллы накапливаются в периферической нервной системе, вызывая прогрессирующую полинейропатию. Пациент чувствует мышечную слабость, онемение, боль, позднее происходит иммобилизация. На терминальных стадиях амилоиды препятствуют работе почек и сердца. Насчитывается более 120 амилоидогенных мутаций, определяющих различный характер проявлений наследственного транстиретинового амилоидоза (рис. 2). Заболевание проявляется в среднем возрасте, неумолимо прогрессирует и вызывает смерть через 5–10 лет. К счастью, в мире им страдают лишь около 50 000 человек. По данным Комитета по лекарственным средствам для орфанных заболеваний (COMP), в Европейском союзе частота встречаемости транстиретинового амилоидоза составляет 0,2 на 10 000 человек.

Рисунок 2. Связь генотипа с клиническими проявлениями при транстиретиновом амилоидозе (hATTR). До появления патисирана спасением для таких пациентов являлась трансплантация печени. В Европе также используют препарат тафамидис, который стабилизирует транстиретин. Он связывается с тетрамером и не дает ему диссоциировать на мономеры. Однако в США он так и не смог получить одобрение.
Человечество стремится познать природу, которая порой нашептывает удивительные решения многих наших задач. Приоткрывая завесу тайны жизни организмов, мы видим изумительные механизмы, созданные эволюцией. Так, например, система CRISPR/Cas, обеспечивающая адаптивный иммунитет прокариот, уже не один год вдохновляет ученых на создание генной терапии с ее помощью.
А вот один из молекулярных механизмов эукариот уже подарил нам первое лекарство и надежду на лечение огромного спектра заболеваний. Попробуем разобраться в тернистом двадцатилетнем пути с момента открытия РНК-интерференции до первого официально одобренного FDA (Food and Drug Administration, Управление США по контролю за лекарствами и пищевыми продуктами) препарата.
ИТАК, КАК ЖЕ ЭУКАРИОТЫ «ВЫКЛЮЧАЮТ» ГЕНЫ И ЗАЧЕМ?
Воздействовать на белок мы можем принципиально тремя способами. Можно придумать молекулу, которая будет связываться с уже синтезированным белком, препятствуя его работе, или, напротив, побуждая его к действию. Так работает большинство лекарств, например, известный анальгетик и жаропонижающее средство ибупрофен ингибирует фермент циклооксигеназу (ЦОГ), уменьшая выработку простагландинов — веществ, ответственных за воспаление.
Но ученые мечтают о новых возможностях: о выключении таргетного гена, вызывающего генетическое заболевание, на уровне ДНК (нокаут) и о выключении без затрагивания самой последовательности ДНК на уровне РНК (нокдаун).
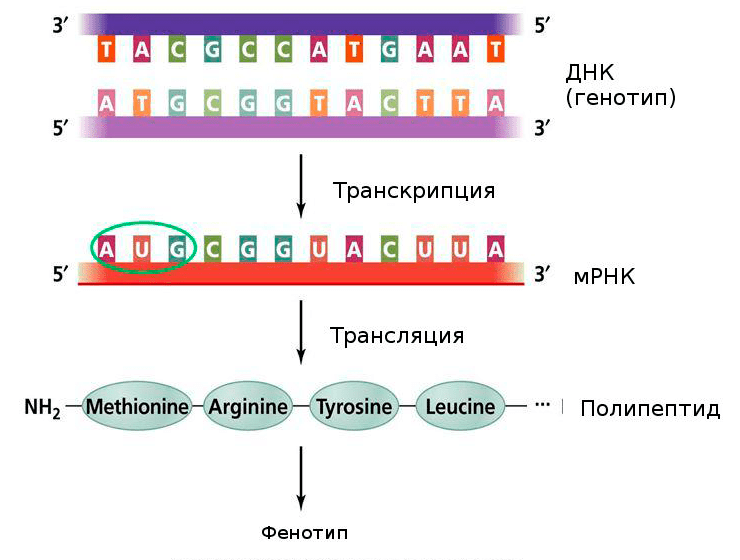
Рисунок 3. Центральная догма молекулярной биологии. Генетическая информация, закодированная в ДНК, переходит в мРНК, и уже с нее синтезируется полипептидная последовательность. Нуклеотиды одной цепочки нуклеиновой кислоты могут быть соединены с нуклеотидами другой по правилу комплементарности. В процессе транскрипции синтезируется смысловая цепь мРНК, и, зная ее последовательность, мы можем синтезировать комплементарную ей цепочку, или антисмысловую цепь.
В своей работе 1996 года Эндрю Файр и Крейг Мело на модельном объекте Caenorhabditis elegans (нематоде) показали, что при внесении двухцепочечной РНК можно полностью «выключить» ген. Как оказалось, происходит это от того, что антисмысловая цепь РНК, комплементарная гену-мишени, вместо ожидаемого повышения экспрессии гена (ведь мы вносим матрицу для трансляции белка) блокирует его синтез. Немногим позже, в 2006 году, за первое применение РНК-интерференции (RNAi) ученые получили Нобелевскую премию.
Процесс начинается с того, что поступившая в клетку экзогенная двухцепочечная РНК связывается с рибонуклеазой Dicer (да-да, как та самая овощерезка), которая нарезает ее на небольшие фрагменты длиной 20–25 пар нуклеотидов, с двумя неспаренными основаниями на каждом конце. Такая длина, видимо, оказалась оптимальной для специфического связывания с мишенью. Эти фрагменты взаимодействуют с белковым комплексом RISC, который отщепляет одну из цепей РНК, оставляя вторую на съедение нуклеазам (ферментам, расщепляющим нуклеиновые кислоты), и путешествует с ней по клетке в поисках таргетной мРНК. Обнаружив ее, белок Аргонавт из комплекса RISC разрезает свою мишень (рис. 1 и 4).
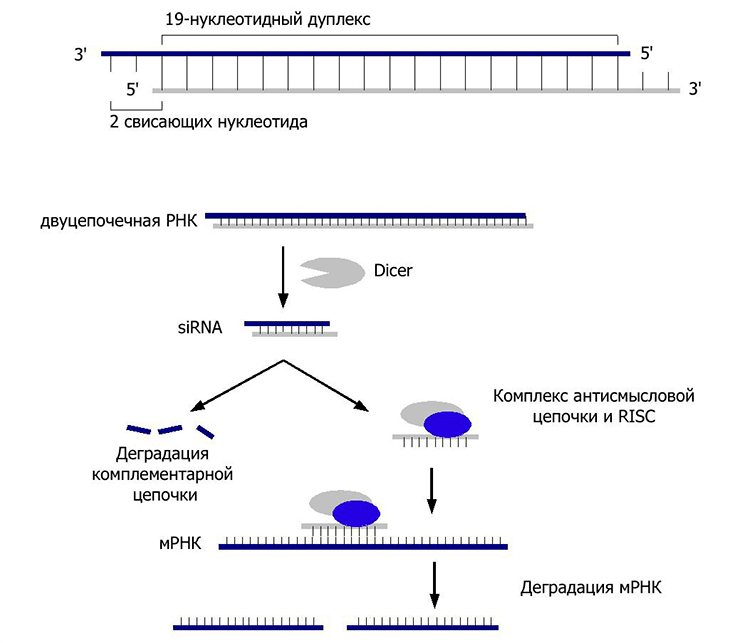
Рисунок 4. РНК-интерференция. Сверху представлена схема строения малой интерферирующей РНК (siRNA). Экзогенная двухцепочечная РНК разрезается ферментом Dicer и встраивается, расплетаясь, в белковый комплекс RISC. Готовый к работе, совместно с siRNA, он путешествует по клетке. При встрече с комплементарной мРНК комплекс индуцирует ее деградацию. Таким образом, клетка уничтожает потенциально вирусную РНК, препятствуя синтезу вирусных белков, а также борется с транспозонами.
Этот механизм выполняет защитную функцию против вирусов, которые стремятся заполучить контроль над клеткой, предоставляя ее белковой машинерии инструкции по производству вирусных агентов. Также интерферирующие РНК могут быть полезны клетке в борьбе с мобильными генетическими элементами, которые активируются при делении клетки и нарушают нормальную работу ее генетического аппарата.
Также стоит отметить, что РНК-интерференция является не единственным механизмом регуляции экспрессии генов. Для трансляции необходимо, чтобы мРНК была одноцепочечной, поэтому при попадании одноцепочечной антисмысловой РНК в клетку блокируется процесс синтеза белка, а также активируется РНКаза H, разрушающая транскрипт.
В КАКИХ СЛУЧАЯХ МЫ МОЖЕМ ИСПОЛЬЗОВАТЬ ЭТОТ ИЗЯЩНЫЙ МЕХАНИЗМ?
Нокаут генов активно применяется в лабораторной практике, в биоинженерии и биотехнологии. Геном можно редактировать с помощью рестриктаз с последующим сшиванием лигазами, воздействовать ретровирусами, несущими правильную копию поврежденного гена, а также использовать уже упоминавшийся метод геномного редактирования с помощью CRISPR-Cas9 — системы белков и РНК.
Проблема с применением большинства таких методов для лечения человека заключается в низкой селективности редактирования, что может вносить дополнительные мутации в геном. Клетки могут перерождаться в раковые, уходить в апоптоз. Данные побочные действия затрудняют применение описанных подходов для лечения генетических заболеваний человека.
Всего этого можно избежать, выключая гены с помощью РНК-интерференции. Очень перспективна разработка антивирусных лекарств, препятствующих связыванию вирусных белков с таргетной клеткой, а также противоопухолевых препаратов.
Так что же останавливало ученых в реализации этой простой идеи?
Все, кто работал в лаборатории с РНК, знают ее коварство: она быстро деградирует под действием РНКаз, находящихся на поверхности кожи, в слюне, и в большом количестве в кровяном русле. Получается, что препарат просто не успевает добраться до нужных клеток, гены которых необходимо выключить с помощью RNAi.
После долгих и дорогостоящих попыток фармкомпании практически потеряли надежду на терапевтическое применение этого механизма. Однако решение было найдено. Сегодня у одной только компании Alnylam известно семь препаратов на основе РНК-интерференции, находящихся на разных стадиях клинических испытаний (табл. 1).
Мишенями таких лекарств являются не только заболевания, связанные с образованием амилоидных бляшек, но и широкий спектр системных дисфункций.
Таблица 1. Стадии клинических испытаний препаратов.

ПАТИСИРАН — ПЕРВЫЙ ОЛИГОНУКЛЕОТИДНЫЙ ПРЕПАРАТ НА ОСНОВЕ РНК-ИНТЕРФЕРЕНЦИИ
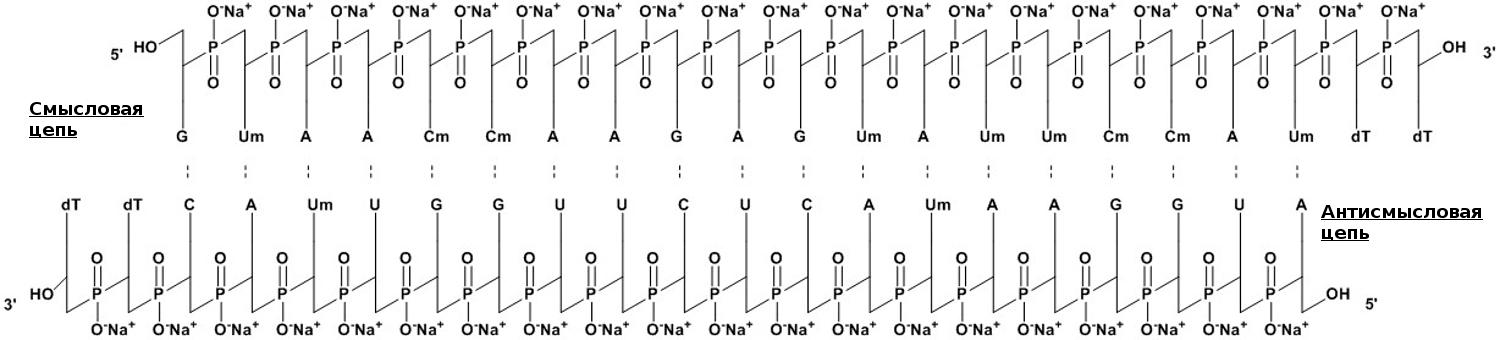
Лекарственная форма патисирана (коммерческое название — Onpattro, «Онпаттро») состоит из РНК, завернутой в липидные наночастицы (LNPs). При создании действующего вещества разработчики использовали короткие, по 21 паре нуклеотидов, двухцепочечные РНК, которые предварительно модифицировали метильной группой, присоединяемой к атомам кислорода (О-метилировали), и защищали с 3′ конца для увеличения стабильности молекулы (рис. 5).
Как вообще можно увеличить стабильность РНК?
Этого можно добиться разными способами. Например, на практике используют комбинации метилирования, блокирования конца или «слабых» мест молекулы с помощью специальных белков и реагентов, а также формирование вокруг лекарственной молекулы защитной оболочки.
Рисунок 5. Нуклеотидная составляющая патисирана представляет собой короткую 21-буквенную двуцепочечную РНК из смысловой и антисмысловой цепей, которая комплементарна таргетному гену транстиретина (TTR). Для бóльшей устойчивости, некоторые из нуклеотидов О-метилированы (Um, Cm), а на 3′ концах пришиты два тимидина (dT). Молекулярная формула лекарства — C412H480N148Na40O290P40. Молекулярный вес составляет 14 304 Да.
Впервые система доставки малых двухцепочных РНК была предложена в 2010 году и после развивалась вплоть до первого успешного клинического испытания в 2016, которое показало возможность применения РНК-интерференции для лечения генетических заболеваний человека.
Липидные наночастицы, защищающие РНК, состоят из внешнего слоя, образованного липидами с полиэтиленгликолем и холестерином, и внутренней полости, заполненной буфером, в которой находятся окруженные катионными частицами интерферирующие агенты (рис. 6).
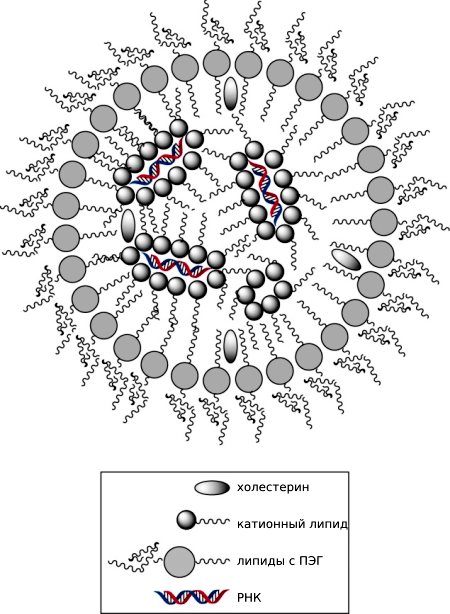
Рисунок 6. Строение липидных наночастиц. Для создания липидных наночастиц эмпирически был разработан специальный протокол, сочетающий различные буферы и типы липидов: смешиваются ионизированные катионные липиды с siRNA в буфере с низкой ионной силой, за счет чего РНК сближаются с липидами и собираются в наночастицы (разноименные заряды катионных липидов и РНК притягиваются). Далее собранные структуры покрываются вспомогательными липидами, холестерином и липидами с полиэтиленгликолем (ПЭГ).
Таким образом, препарат таргетно доставляется в гепатоциты — клетки, продуцирующие амилоидный транстиретин.
КЛИНИЧЕСКИЕ ИСПЫТАНИЯ
Любое лекарство проходит через несколько так называемых фаз клинических испытаний перед тем, как будет допущено к продаже и широкому клиническому применению.
Для патисирана все клинические испытания прошли успешно. В последней, третьей фазе участвовало 225 пациентов с наследственным транстиретиновым амилоидозом (hATTR), из которых 77 получали плацебо. Ключевым показателем оценки состояния пациентов являлась модифицированная шкала ухудшения нейропатии (mNIS+7). Также использовали тест на ходьбу на расстояние 10 м, оценку индекса массы тела и опрос о качестве жизни. Наблюдение продолжалось в течение 18 месяцев. mNIS+7 ранжируется от 0 до 304 баллов: чем больше, тем хуже состояние пациента (рис. 7). По всем показателям выявили значимое улучшение состояния пациентов по сравнению с группой, принимавшей плацебо.
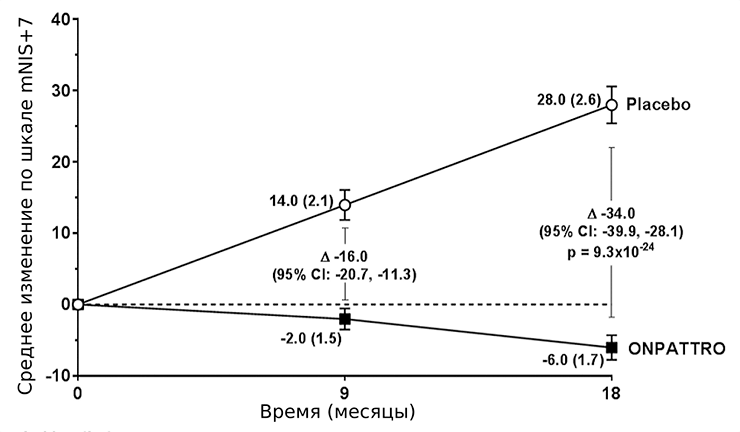
Рисунок 7. Динамика изменений средних значений модифицированной шкалы ухудшения нейропатии (mNIS+7). Разница между группами составляет 34,0 пунктов при p<0,001.
Во время клинических испытаний возникли побочные эффекты: у 10% пациентов, принимавших лекарство, и 3%, принимавших плацебо, выявили инфекции верхних дыхательных путей. У всех пациентов наблюдали падение концентрации витамина А в крови (вспомним функции транстиретина).
FDA одобрило лекарство для всех стадий заболевания 10 августа 2018 года — так, патисиран стал не только первым одобренным препаратом для лечения наследственного транстиретинового амилоидоза, но и первым одобренным средством, в механизме работы которого лежит РНК-интерференция.
Комитет по лекарственным средствам для человека (CHMP), входящий в Европейское агентство лекарственных средств (EMA), рекомендовал предоставить разрешение на применение патисирана для лечения наследственного транстиретин-опосредованного амилоидоза у взрослых пациентов с полинейропатией 1 или 2 стадий. Значимого улучшения состояния пациентов с 3 стадией заболевания, по результатам клинических тестов и судя по комментариям представителя компании, достичь не удалось.
Лекарство будет доступно в виде раствора для внутривенного введения с концентрацией активного компонента 2 мг/мл. Примечательна периодичность инъекций: один раз в три недели.
На данный момент стоимость годового курса составляет $450 000, в ближайшее время предполагается снижение стоимости до $350 000. Назначение патисирана, к сожалению, не покрывается всеми страховыми планами.
Компания Alnylam предоставляет несколько типов финансовых тарифов для пациентов разных категорий. Рассмотрим два из них:
- У пациента есть коммерческая страховка.Компания предоставляет программу быстрого старта, обеспечивающую до трех доз лекарства в ожидании подтверждения страхового покрытия без каких-либо затрат. После подтверждения лечение полностью оплачивается страховой фирмой.
- У пациента нет страховки или его заболевание не подпадает под страховой случай.Компания может предоставить лекарство бесплатно, если у пациента есть Medicare, Medicaid (национальные системы страхования в США) или любое другое спонсируемое правительством страхование. Также покрытие полной стоимости или ее части возможно за счет нескольких частных фондов и благотворительных организаций. В данном случае пациенту приходится ждать соблюдения всех формальностей, он не получает лечение сразу.
Нам удалось узнать подробнее о планах компании Alnylam на расширение рынка препарата. На данный момент патисиран доступен на территории США, о продаже на территории России речи пока не идет. Авторы надеются, что с течением времени терапия станет ближе для бóльшего числа больных.
КТО НАС ЖДЕТ ТЕПЕРЬ?
Как мы смогли убедиться, создание RNAi-препаратов сопряжено с огромными трудностями, связанными с доставкой хрупких РНК к клеткам. Сегодня остается еще много вопросов касательно дизайна и применения липидных наночастиц.
Это перспективное направление открывает, в первую очередь, невероятные возможности для лечения генетических заболеваний человека. Доказанная эффективность патисирана способствует дальнейшему исследованию РНК-интерферирующих агентов, их применению в клинической практике и еще большему накоплению багажа знаний. Возможно, когда-нибудь, мы увидим в аптеках волшебные лекарства против всего, а, может быть, приблизимся к «Дивному новому миру» Олдоса Хаксли. Время покажет.
Источник: БИОМОЛЕКУЛА