В 2017 году Нобелевскую премию по химии присудили за развитие методов визуализации под общим названием криоэлектронная микроскопия (крио-ЭМ). Нобелевский комитет посчитал, что метод произвёл настоящую "революцию в области биохимии".
Поясним, что в биохимии картинка – это ключ к пониманию природы объекта исследований. Многие научные прорывы совершаются именно благодаря улучшению методов визуализации, позволяющих изучать объекты, невидимые для человеческого глаза.
Крио-ЭМ позволяет учёным исследовать образец (например, биомолекулы) в родной среде при криогенных температурах (то есть температуре, при которой азот находится в жидком состоянии).
Спустя год учёные из Университета Отаго и Института науки и технологии Окинавы (OIST) использовали крио-ЭМ для изучения потенциала вирусов, способных уничтожать рак. Как говорят специалисты, подобная визуализация поможет учёным генетически модифицировать вирус, дабы повысить его эффективность.
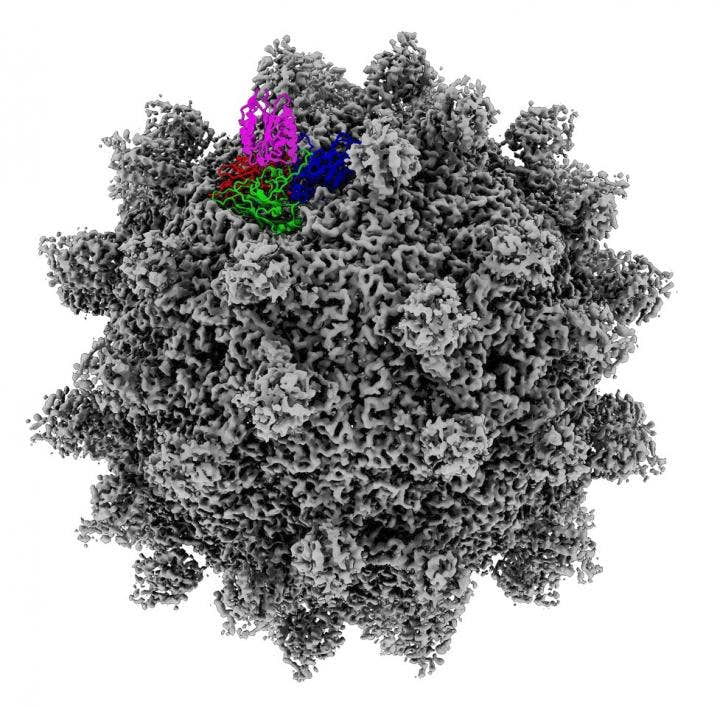
Снимок, сделанный при помощи криоэлектронной микроскопии.
"Сегодня криоэлектронная микроскопия – одна из самых ярких областей биологических наук, — считает соавтор работы Михня Бостина из Университета Отаго. — Теперь мы можем фиксировать в стекловидном льду (то есть почти в естественных условиях – прим. ред.) интересующую нас молекулу. Мы можем использовать современные микроскопы для сбора тысяч изображений с очень высоким разрешением, которые затем можно анализировать с помощью сложных алгоритмов".
Таким образом, продолжает учёный, у специалистов есть очень хороший метод визуализации образцов. "В результате мы можем детально изучить структуру важных молекулярных объектов", — добавляет Бостина.
Бостина и его коллеги сосредоточились на изучении вируса Seneca Valley Virus (SVV). Он, как и другие противораковые вирусы, рассматривается в качестве возможного оружия против опасных заболеваний. Дело в том, что вирус способен избирательно нацеливаться на опухолевые клетки, оставляя здоровые клетки невредимыми.
SVV считается особенно перспективным противораковым вирусом, поскольку он "цепляется" за рецептор ANTXR1. Последний встречается почти в двух третях опухолей человека.
В нынешней работе специалисты попытались выяснить, как вирус "умышленно" связывается с ANTXR1 на опухолевых клетках и почему он не проявляет никакого интереса к близкому "родственнику" ANTXR2. Последний присутствует только в здоровых тканях.
Ранее специалистам было очень трудно понять, что является причиной столь высокой избирательности. Новая же реконструкция вируса выявила ранее неизвестные черты его внешней оболочки, которые прекрасно сочетаются со структурными особенностями ANTXR1 (у ANTXR2 таких нет).
"Компоненты должны соответствовать друг другу, как ключ и замок. Это высокоразвитая система, где всё идеально подходит друг другу", — говорит один из авторов работы Матиас Вольф из OIST.
По мнению Бостина, выявление таких характеристик поможет учёным усилить вирус для борьбы с раком. Открытие может пригодиться во многих направлениях исследования рака, учитывая распространённость ANTXR1 и способность SVV "открывать многие двери".
Впрочем, не всё так просто. Один из недостатков SVV заключается в его природе: он всё-таки является вирусом, следовательно, он вызывает иммунную реакцию у пациента. В итоге организм убивает вирус в течение нескольких недель. Теоретически SVV требуется гораздо больше времени, что инфицировать раковые клетки.
"Если мы хотим сделать вирус более эффективным при вторжении в раковые клетки, мы можем оставить нетронутой ту часть, которая взаимодействует с раковыми клетками, и изменить остальное, чтобы вирус мог избежать атак со стороны иммунной системы", — говорит учёный.
Источник: ВЕСТИ.RU

