Большая часть медико-биологических исследований проводится на клетках in vitro (то есть, не на живом организме, а на клетках «в пробирке»). Клетки используют в качестве модельного биологического объекта в научных исследованиях, при тестировании и производстве лекарств. Кроме этого, ученые научились исправлять генетические ошибки в клетках и наделять их способностью противостоять некоторым заболеваниям, что служит основой для медицинских технологий будущего — генной и клеточной терапий. Эта статья расскажет о методах работы с клетками, а также о возможностях и ограничениях, связанных с их использованием.
ЗАЧЕМ НУЖНЫ ИЗОЛИРОВАННЫЕ КЛЕТКИ
Объектом биологических и молекулярно-биологических исследований являются живые организмы, но работа с ними довольно трудна. Во-первых, это дорого и долго. Во-вторых, изучать молекулярные механизмы в живом организме чрезвычайно сложно из-за колоссального числа взаимосвязанных компонентов и низкого разрешения методов анализа: очень сложно выделить эффекты одного изучаемого процесса из миллионов других событий, происходящих в том же организме в то же время. В-третьих, на самой интересной живой системе — человеке — эксперименты и вовсе запрещены. Поэтому ученым приходится исследовать организм по частям, что имеет несомненные преимущества, но и существенные ограничения.
Составными частями организма являются органы, которые в свою очередь состоят из тканей, а те — из клеток (рис. 1). В настоящее время исследователи учатся создавать трехмерные тканевые структуры, но до выращивания полноценных органов in vitro пока далеко. Выделение отдельных органов и поддержание их жизнедеятельности вне организма пока более сложная задача, чем их исследование в составе организма.
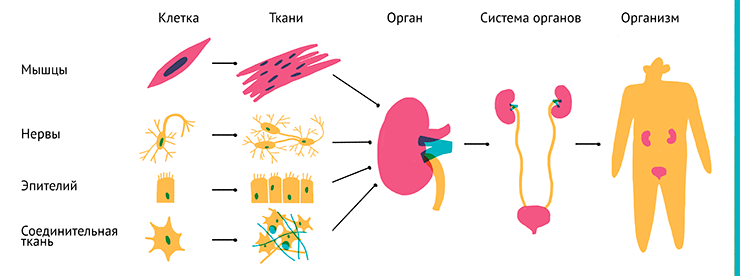
Рисунок 1. Иерархическая организация живых организмов.
Поэтому наиболее распространенным модельным объектом молекулярно-биологических исследований в наше время являются клеточные культуры. Клеточная культура — это клетки (как правило, клетки животных или человека, принадлежащие одной ткани), выращиваемые обычно в пластиковых флаконах, планшетах или чашках Петри в специальной питательной среде при контролируемых температуре, влажности и уровне углекислого газа (рис. 2). Клеточные культуры многочисленны, разнообразны, доступны, относительно просто культивируются. Для них легко контролировать внешние условия и воздействовать изолированными стимулами, а для анализа имеется богатый арсенал методов. Многие методы при работе с клетками позволяют получить принципиально новую информацию, нежели при изучении организма, срезов или гомогенатов ткани. Так, например, один из основных методов анализа клеток — флуоресцентная микроскопия — позволяет в живых культивируемых клетках «увидеть» единичные молекулы с пространственным и временным разрешением в несколько десятков нанометров и микросекунд соответственно. Это на 4–6 порядков лучше разрешения методов рентгеновской томографии и МРТ и на 2–3 порядка — прижизненной оптической микроскопии мелких прозрачных животных (рыбок «зебра», личинок насекомых, эмбрионов ранних стадий).

Рисунок 2. Емкости с клеточными культурами в специальном инкубаторе.
Помимо этого, культуры клеток нашли широкое применение в биотехнологиях, производстве лекарств и вакцин. За последние 10 лет запущено около тысячи клинических испытаний протоколов клеточной терапии (то есть пересадки клеток для лечения заболевания), для некоторых из которых уже доступны результаты (на сайте clinicaltrials.gov и по ссылкам на странице исследования). Очевидно, что за клеточной терапией будущее, и она откроет медицине недоступные прежде рубежи.
Краткая история развития клеточных технологий
1665 г. — Р. Гук впервые наблюдает ячеистое клеточное строение растений.
1683 г. — А. Левенгук открывает одноклеточные организмы.
1839 г. — М. Шлейден и Т. Шванн создают клеточную теорию.
1909 г. — А. Максимов находит стволовые клетки.
1925 г. — Создается коллекция клеток ATCC.
1948 г. — Показана возможность производства вакцин в культуре клеток.
1951 г. — Получена линия клеток HeLa.
1961 г. — Л. Хейфлик обнаруживает предел числа делений человеческих клеток in vitro.
1968 г. — А. Фриденштейн находит мезенхимальные стволовые клетки.
1975 г. — Разрабатывается технология гибридoм и производства моноклональных антител. Авторы открытия — Мильштейн, Келер и Ерне — в 1984 г. получают Нобелевскую премию по физиологии и медицине.
1981 г. — Получены эмбриональные стволовые клетки мыши.
1996 г. — Клонирована овечка Долли путем переноса ядра между клетками (В. Рослин).
1997 г. — Получены эмбриональные стволовые клетки человека.
2006 г. — Получены индуцированные плюрипотентные стволовые клетки, за что Ш. Яманака в 2012 г. получает Нобелевскую премию (вместе с Дж. Гордоном, который за несколько десятков лет до этого провел клонирование лягушки, заложив основу для последующих исследований).
2017 г. — В России принят закон «о биомедицинских клеточных продуктах», регулирующий применение клеток для терапии.
КЛЕТОЧНЫЕ КУЛЬТУРЫ: КАК ИХ ПОЛУЧАТЬ И ДЛЯ ЧЕГО ИСПОЛЬЗОВАТЬ?
Биомолекулы, клетки и организм: части и целое
Прежде чем перейти к методам, рассмотрим, что собой представляют клетки in vitro и чем они отличаются от клеток в составе организма. Это важно, так как конечная цель экспериментов на клетках — понимание молекулярных механизмов функционирования именно организма, а не клетки. Переход от клеток к организму гораздо сложнее, чем может показаться на первый взгляд. По ходу статьи мы еще будем возвращаться к этому вопросу, а сейчас рассмотрим некоторые общие моменты.
Живой объект состоит из более мелких составных частей: органов, тканей, клеток, органелл, биомолекул и одновременно является частью более масштабных систем — таких как пищевые цепочки, экосистемы, сообщества. Еще Гиппократ и Аристотель задавались вопросом соотношения целого и его частей и сошлись в понимании, что целое есть больше, чем сумма частей. Однако современная наука почти полностью полагается на альтернативный принцип — редукционизм, — в соответствии с которым познание целого осуществляется через познание его составных частей. При таком подходе теряются связи между частями, в нашем случае — между клетками. Хотя каждая клетка есть тоже, по сути, целое, но вне организма это уже не совсем та клетка, что была в его составе. Что меняется при таком переходе?
Наглядной иллюстрацией служат слизевики. Эти одноклеточные обладают способностью объединяться из десятков тысяч клеток в плазмодий, который в поисках еды может быстро передвигаться и выбрасывать споры на большое расстояние, а потом вновь распадаться на отдельные клетки. Когда слизевики ищут еду, отдельные клетки объединяются и формируют плазмодий до 2 мм длиной (видео 1). Многие бактерии тоже обладают способностью формировать плотные конгломераты — биофильмы, или биопленки, в которых внутренние клетки защищены внешними от окружающей среды. То есть объединение в многоклеточные структуры приводит к возникновению новых функций, отсутствующих у отдельных клеток. Конкурентные преимущества за счет приобретения новых способностей послужили причиной объединения одноклеточных организмов в многоклеточные около 1 млрд лет назад.
В многоклеточных организмах клетки существуют в неразрывной связи друг с другом на протяжении сотен миллионов лет эволюции и за это время полностью перестроились на выполнение конкретных функций. Спектр экспрессируемых клеткой генов, ее функции и активность, форма и размер, скорость деления и гибель регулируются связями с другими клетками организма. У млекопитающих эта связь основана на всевозможных сигналах: химических (гормоны, цитокины, ростовые факторы, питательные вещества, производные кислорода, ионы металлов и др.), везикулярный транспорт с кольцевыми РНК и микро РНК посредством их клетки тканей сообщают стволовым что необходимо деление и предупреждают о вирусах, а также модифицируют (метилирование ДНК) предшественников половых клеток, механических и электрических (передаваемых нейронами).
Межклеточная коммуникация лежит в основе процессов, изучаемых почти всеми медицинскими дисциплинами, в частности эндокринологией, неврологией, кардиологией, гематологией и др., но о полной расшифровке этих взаимодействий пока говорить не приходится. Если у клетки в организме нарушаются нормальные связи с окружением, она либо умирает (для этого существуют специальные механизмы самоуничтожения — апоптоз, аноикис и др.), либо становится «асоциальной», то есть раковой. При выделении из организма и переносе в чашку Петри клетки тоже теряют почти все внешние связи, но в благоприятных условиях некоторое время живут и делятся (однако могут стать и раковыми).
В новых, искусственных условиях клетки сохраняют лишь геном, а все остальные свойства меняются — размер, скорость роста, экспрессия генов, функциональная активность, чувствительность к лекарствам, метаболизм, состав мембран и другие. В связи с этим сегодня ведется активный поиск условий in vitro, которые максимально воспроизводят условия in vivo. Большинство тканей организма содержат несколько типов клеток, имеют сложную структуру внеклеточного матрикса и пронизаны сетью сосудов и нервов (рис. 3). Полностью воссоздать такую архитектуру in vitro пока невозможно, а значит, и клетки в культуре пока остаются лишь приближением к клеткам в составе организма.

Рисунок 3. Сложная организация соединительной ткани in vivo, состоящей из: нескольких типов клеток (фибробласты, жировые клетки, макрофаги и другие лейкоциты), нескольких типов волокон (1 — эластичные, 2 — ретикулярные и 3 — коллагеновые), нервов и сосудов, заключенных в гидрогель из полисахаридов.
Выделение и культивирование клеток
Источником клеток может быть любая ткань организма. В большинстве тканей клетки находятся внутри так называемого внеклеточного матрикса, который разделяет ткань на области и формирует ее архитектуру (рис. 3 и 4). Внеклеточный матрикс состоит из белков, образующих фибриллы: коллагена, фибронектина, эластина и протеогликанов с длинными полисахаридными ветвями (гликозаминогликанами). Последние великолепно удерживают жидкость и формируют в бoльшей части внеклеточного пространства так называемый гидрогель. В случае кости матрикс формируется из кристаллизованного фосфата кальция. Самый распространенный из белков человека — коллаген: он составляет до 30% массы всех белков организма. Компоненты матрикса синтезируются многими клетками, но специализируются на этом фибробласты.
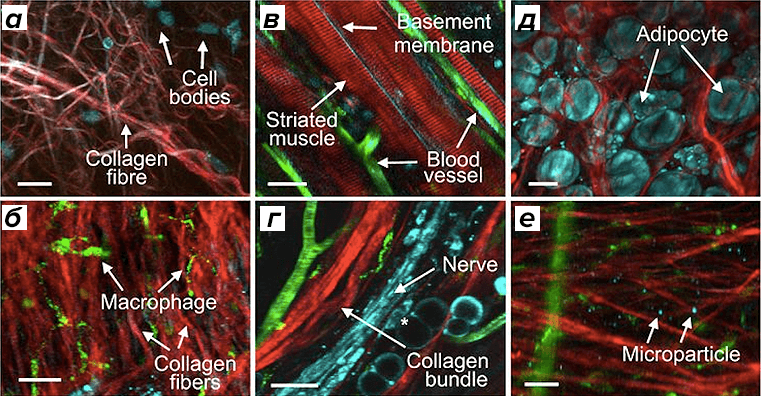
Рисунок 4. Как выглядят ткани под микроскопом: прижизненная мультифотонная микроскопия различных участков кожи, содержащих рыхлую (а) и плотную (б) соединительные ткани, мышечные (в) и нервные волокна (г), жировые клетки (д) и микровезикулы (е). Коллагеновые волокна изображены красным цветом (кроме в), кровеносные сосуды — зеленым, клетки и микровезикулы — голубым (на б — зеленым). Шкала размера — 50 мкм.
Для выделения клеток необходимо разрушить внеклеточный матрикс и разорвать связи между клетками, после чего клетки «рассыпаются» (рис. 5). Клеточную культуру можно получить и другим способом: поместив в культуральную среду кусок ткани целиком, и тогда часть клеток постепенно выползет и засеет окружающее пространство. Такой тип культуры называется эксплантом. Выделение и манипуляции с клетками обычно проводят в специальном стерильном боксе — ламинарном шкафу (рис. 6а).
Рисунок 5. Схема выделения клеток из ткани. Фрагмент ткани, полученный прижизненно (биопсией) или после смерти, измельчают механически и обрабатывают протеолитическими ферментами, расщепляющими внеклеточный матрикс (трипсином, коллагеназой, гиалуронидазой, папаином или их комбинациями). В дополнение к ферментам используют кальций-связывающие соединения (хелаторы), которые забирают кальций у молекул клеточной адгезии и ослабляют их связь между собой и с внеклеточным матриксом. Добавление ДНКазы позволяет предотвратить склеивание клеток в тягучие сгустки за счет электростатических взаимодействий с высвободившейся из поврежденных клеток ДНК. После этого клетки отделяют от обломков матрикса (дебриса) центрифугированием и/или фильтрацией и высаживают в культуральные флаконы или чашки Петри.
У некоторых тканей нет внеклеточного матрикса или клетки не связаны с ним, что существенно упрощает процедуру выделения. Это относится, главным образом, к клеткам крови и их предшественникам, находящемся в костном мозге. Благодаря легкости выделения и сохранности поверхностных молекул для этих клеток наиболее хорошо изучено разнообразие типов и пути их формирования из стволовой клетки крови (гемопоэтической СК).
После выделения клетки помещают в питательную среду и растят в чашках Петри или флаконах в атмосфере углекислого газа (5% CO2) и близкой к 100% влажности в CO2-инкубаторах (рис. 6б). Питательная среда состоит из физиологических солей, буфера pH, аминокислот, витаминов и глюкозы, а также белковых ростовых и питательных факторов (см. врезку ниже). Добавляемый к среде индикатор феноловый красный позволяет визуально контролировать pH и придает среде красный цвет.

Рисунок 6а. Основное оборудование для культуральных работ — ламинарный шкаф. Ламинарный шкаф обеспечивает равномерный вертикальный поток стерильного воздуха, защищая культуру клеток от микробного заражения.

Рисунок 6б. Основное оборудование для культуральных работ — CO2-инкубатор. Углекислый газ в CO2-инкубаторе, во-первых, позволяет лучше воспроизвести условия in vivo, а, во-вторых, необходим для поддержания pH среды, в которой, как правило, используется бикарбонатная CO2-зависимая буферная система. В инкубаторе поддерживается близкая к 100% влажность, что предотвращает испарение жидкости и концентрирование ее компонентов.
Белковые ростовые и питательные факторы
Белковые факторы являются наиболее тонким местом при культивировании клеток. Самым распространенный источник этих факторов — сыворотка животных, обычно телячьих эмбрионов, реже лошадиная или из такого же животного, что и сами клетки. Клеткам добавляют цельную фильтрованную сыворотку с разбавлением до 1–10%. При исследовании действия каких-либо веществ на клетки (факторов роста, белковых гормонов, цитокинов) сыворотка создает сильный фон, который необходимо снижать, выращивая клетки без сыворотки (депривация) в течение 2–72 ч перед экспериментом. Использование сыворотки почти не поддается стандартизации и является потенциальным источником инфекций, что существенно ограничивает ее применение при производстве биомедицинских продуктов. Альтернатива сыворотке — белковые добавки стандартного состава из очищенных и рекомбинантных белков.
После выделения клетки в течение нескольких часов (до суток) восстанавливаются от стресса («ремонтируют» мембрану, восстанавливают отрезанные ферментами рецепторы) и затем начинают приспосабливаться к новым условиям (прикрепляются к доступным поверхностям, переходят на новый режим метаболизма, изменяют форму и экспрессию генов и т.д.). Исключением являются клетки крови и кроветворные клетки из костного мозга, которые выделены без использования ферментов и могут быть проанализированы сразу после выделения. В культуре некоторые клетки крови тоже могут прикрепляться к поверхностям, активироваться и активировать другие клетки. Эти изменения можно затормозить (они ведь неестественные и искажают нормально происходящие в клетках процессы), если поддерживать клетки в суспензии, не давая им прикрепляться за счет использования специальных поверхностей, полужидких сред или постоянного покачивая.
При необходимости запечатлеть клетки в их нативном состоянии, исследования желательно проводить в первые сутки после выделения: за это время клетки еще не успеют сильно изменить свой первоначальный облик. Хотя для этих целей обычно работают со срезами тканей, клетки, в отличие от срезов, дают возможность использовать прижизненную микроскопию и цитометрию. Стоит отметить, что микроскопию уже научились проводить и на живых животных (интравитальная микроскопия, но разрешение и возможности этого подхода пока ограничены. Для большинства других задач клетки поддерживают в культуре и анализируют спустя более длительное время после выделения.
Разновидности клеточных культур
Клеточные культуры различают по их источнику, наличию общего предка, способности клеток размножаться, прикрепляться к поверхности, образовывать многоклеточные конгломераты и др.
В лабораторной практике наиболее распространены раковые клетки. Они не имеют предела числа делений, будучи фактически бессмертными, что позволяет наращивать их в неограниченном количестве. Поскольку при постоянном росте клеток место в чашке Петри (или в объеме культуры) периодически кончается, время от времени их нужно пересевать: откреплять от поверхности, разбивать клеточные скопления с помощью ферментов и ЭДТА (хелатор кальция), а потом заново сеять в меньшей плотности, что позволяет им размножаться дальше. Эта процедура называется пассированием, а возраст культуры часто считают по числу таких пассажей.
Через несколько пассажей после выделения из опухоли раковые клетки полностью вытесняют все остальные и становятся однородными. Такие культуры называют клеточными линиями или линейными клетками. Возможно, самой распространенной клеточной линией сегодня является линия клеток рака шейки матки HeLa (рис. 7), полученная в 1951 г. от пациентки Генриетты Лакс, умершей вскоре после взятия этих клеток.
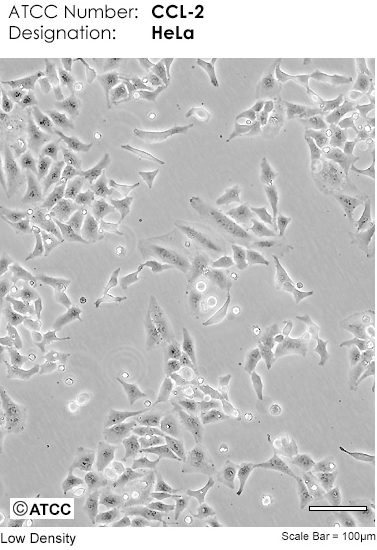
Рисунок 7. Микрофотография раковых клеток линии клеток HeLa.
Раковые клетки даже в организме сильно отличаются от нормальных, а в культуре это отличие только увеличивается. Так, многие раковые линии имеют увеличенный набор хромосом (анеуплоидия), что делает их более устойчивыми к повреждению ДНК. Кроме этого, многие типы раков вызваны вирусными инфекциями, передающимися и клеточным культурам, что не позволяет использовать эти клетки в производстве вакцин (см. ниже). В связи с этим в фармакологии и научных исследованиях широко востребованы линии «нормальных» — не раковых — клеток.
Именно производство вакцин послужило основным мотивом получения культуры «нормальных» клеток. С этой целью Леонард Хейфлик (рис. 8б) выделял клетки из абортивного материала и обнаружил наличие предела числа делений клеток в культуре, получившего название предела Хейфлика. Для человеческих клеток этот предел составляет 50–70 делений и обусловлен укорочением теломер — фундаментальным противораковым механизмом старения клеток.
В 1965 году Хейфлик получил линию фибробластов легкого WI-38 (рис. 8а), которая смертна, но была наработана и заморожена в достаточном количестве, чтобы обеспечить исследования по всему миру и по сегодняшний день. Благодаря человеческому происхождению, отсутствию вирусных инфекций и раковой трансформации эта линия нашла широкое применение в производстве вакцин. Сейчас, однако, фармкомпании опасаются, что конечный ресурс данной линии не позволит им завершить начатые исследования, и переходят на другие линии. В настоящее время эта линия широко используется для изучения молекулярных механизмов старения.
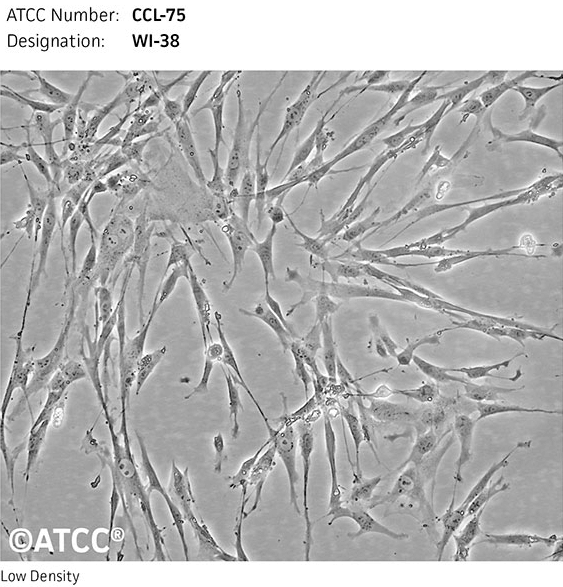
Рисунок 8а. Микрофотографии нормальных эмбриональных фибробластов линии WI-38.

Рисунок 8б. Их «автор» — Леонард Хейфлик
Некоторым компромиссом между раковыми и нормальными являются иммортализованные клетки: полученные из нормальной ткани, они приобрели способность к неограниченному числу делений. Такой переход к бессмертию может происходить либо спонтанно, либо в результате искусственного введения определенных генов или слияния с раковыми клетками, как в случае гибридoм. «Бессмертие» клеткам могут придать онкогены: большой Т-антиген вируса SV40, H-Ras, c-myc, E1A. Эти гены по сути вызывают опухолевую трансформацию клеток со всеми вытекающими недостатками (нестабильность генома, потеря физиологических функций и т.д.). Наиболее деликатный и получающий все большее распространение способ иммортализации — это введение в клетку гена теломеразной обратной транскриптазы (TERT), которая достраивает теломеры и предотвращает их укорачивание при делении (рис. 9). За открытие теломеразы в 2009 году была присуждена Нобелевская премия по физиологии и медицине.
Хотя такая трансдукция тоже является, по сути, онкогенной, она позволяет лучше сохранить физиологические функции и меньше дестабилизировать геном по сравнению с трансдукцией другими онкогенами. Также стоит отметить, что этот метод работает не для всех клеток: например, он не подходит для Т- и B-клеток.
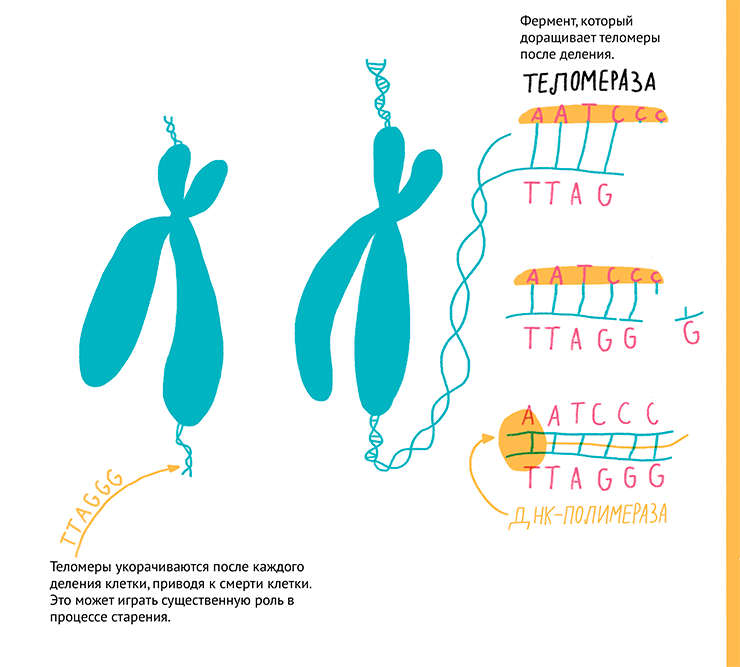
Рисунок 9. Концевые участки хромосом — теломеры — укорачиваются при каждом клеточном делении, и при их истощении в клетке запускается механизм самоуничтожения. Теломеры у позвоночных состоят из повторяющихся последовательностей нуклеотидов TTAGGG. При каждом делении эти участки укорачиваются, но теломераза TERT предоставляет собственную одноцепочечную ДНК в качестве матрицы, с которой сама синтезирует сначала одну цепь, а потом ДНК-полимераза достраивает и вторую цепочку ДНК теломер. Таким образом теломераза способна поддерживать бессмертие клеток.
Дифференцированные клетки (которые приобрели свою конечную специализацию) составляют бoльшую часть клеток организма и практически не делятся. Будучи основными составляющими и «рабочими лошадками» во всех органах и тканях, они служат мишенью действия большинства лекарств, что делает их весьма востребованными для исследований. В культуре их можно получить путем направленной дифференцировки плюрипотентых стволовых клеток в нужный тип клеток (см. далее), однако этот путь имеет существенные технические и, в случае человеческих клеток, еще и этические сложности.
Наиболее распространенными культурами дифференцированных клеток являются первичные клеточные культуры — клетки, выделенные из зрелой ткани и не пассированные in vitro (рис. 10). Число делений таких клеток критически зависит от условий культивирования, но редко составляет более 5–10 раз. Исключением являются стволовые, прогениторные и некоторые специализированные клетки, например, активированные Т- и B-лимфоциты. Кроме того, при длительном культивирование первичная культура склонна к замещению фибробластами.
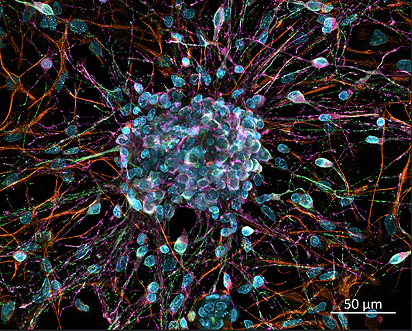
Рисунок 10. Пример первичной клеточной культуры: нейроны.
Многие исследования выполняются именно на первичных клеточных культурах, обладающих рядом преимуществ по сравнению с раковыми и иммортализованными клетками:
- Они гораздо лучше соответствуют клеткам in vivo: нейроны проводят электрические импульсы, гепатоциты секретируют альбумин, макрофаги фагоцитируют бактерии и т.д.
- Если говорить о клетках животных, они легко доступны при наличии вивария — остается лишь получить их (что, впрочем, довольно трудоемко). Доступность человеческих клеток определяется типом ткани: распространены культуры эндотелиальных клеток из пуповинной вены (HUVEC) и мезенхимальных стромальных клеток из жировой ткани, источниками которых служат побочные продукты акушерства и хирургии соответственно.
- Они несут генотип донора, а поэтому могут использоваться для изучения причин патологий конкретного пациента на молекулярном уровне.
Культуры клеток человека, мыши, крысы, кролика и других животных собраны в коллекциях, хранящихся в жидком азоте при температуре −196 °C (рис. 11). Наиболее полная коллекция — ATCC в США — насчитывает более 4600 клеточных культур эукариот. В МГУ сейчас создают уникальный по своим масштабам депозитарий живых систем «Ноев ковчег», в котором среди всевозможных образцов живых объектов есть и клетки животных и человека. Некоторые институты тоже имеют свои коллекции: например, в ИБХ РАН коллекция организована по принципу облачного хранилища с общим журналом и клетками, распределенными по разным лабораториям.
Линии клеток из коллекций можно купить; они существуют почти для каждого типа опухоли и здоровой ткани и детально охарактеризованы. Это позволяет подобрать наиболее подходящие для конкретного исследования линии и сравнивать результаты с полученными ранее в своей или в других лабораториях.

Рисунок 11. «Биобанк». Клеточное хранилище ATCC (США).
Использование клеток в научных исследованиях
Клеточные культуры являются прежде всего инструментом для научных исследований. Какие возможности дает этот инструмент и для чего его можно использовать? Для клеток в культуре имеется богатый арсенал методов манипуляции и анализа. Здесь мы кратко остановимся на основных, но перед этим обсудим уникальные преимущества клеточных культур как модельных объектов.
В отличие от клеток в организме, для клеток в культуре исследователь полностью определяет внешние условия. Хотя эти условия часто и не соответствуют условиям in vivo, воспроизводимость и контроль позволяют ставить точные эксперименты и выявлять ответ клеток на определенные стимулы. Для изучения внутриклеточных процессов эта возможность уникальна, но надо помнить, что, чем сильнее клетки в культуре отличаются от клеток в организме, тем больше вероятность, что механизмы этих процессов тоже будут отличаться.
В клетке находится отнюдь не разбавленный раствор, используемый в биохимических и структурных исследованиях, а очень плотное и насыщенное микроокружение (crowded environment) (рис. 12 и видео 2 - Трехмерная реконструкция различных внутриклеточных структур в срезе). Как следствие, активности молекул в искусственном растворе и «в жизни» иногда отличаются на несколько порядков. Именно поэтому клетка является гораздо более адекватной моделью при изучении активностей и взаимодействий биомолекул и при анализе воздействия потенциальных лекарств на молекулы-мишени в фармакологии.
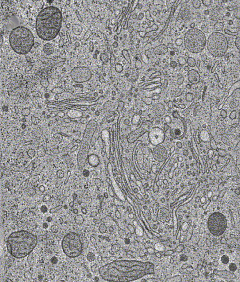
Рисунок 12. В клеточной тесноте. Криоэлектронная томография тонкого (400 нм) среза клеток линии HIT-T15.
Желтый — эндоплазматический ретикулум, синий — мембранно-связанные рибосомы, оранжевый — свободные рибосомы, светло-зеленые нити — микротрубочки, голубой — плотные коровые везикулы, белый — клатрин-негативные везикулы, светло-красный — клатрин-содержащие везикулы, пурпурный — клатрин-негативные компартменты, полости со светло- и темно-зелеными внутренними и внешними поверхностями — митохондрии. Отдельные молекулы и комплексы малого размера не отображены.
Как доставить ген в клетку?
Если интересующая нас молекула — белок, то самый простой способ поместить его в клетку и изучить — это заставить его синтезироваться прямо «на месте», введя внутрь клетки ген этого белка. Существует множество методов доставки генов в клетки (рис. 13), как на основе чисто физико-химических принципов (трансфекция), так и с использованием вирусов в качестве носителя (трансдукция).
Эффективность трансфекции существенно зависит от типа клеток и методики: для раковых и иммортализованных клеток это обычно 30–80%, однако для первичных клеток — редко более 10%. Исключением является метод электропорации, который иногда позволяет добиться высокой эффективности доставки генов в первичные культуры. Химические методы трансфекции не предназначены для встраивания введенного гена в геном клетки, и со временем введенная ДНК теряется.
Небольшая доля ДНК все-таки может закрепиться в геноме при трансфекции и передаваться по наследству, что позволяет получить линию со стабильной экспрессией введенного гена. Отбор ведется путем селекции таких клеток по устойчивости к антибиотику (вместе с исследуемым геном обычно вставляют и ген, обеспечивающий такую устойчивость) или с помощью нескольких циклов клеточной сортировки.
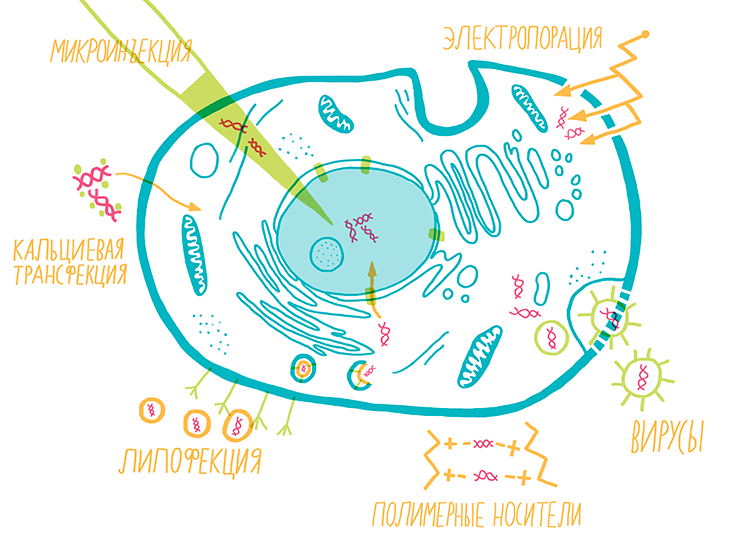
Рисунок 13. Методы трансфекции и трансдукции. Для внедрения гена в клетку необходимо преодолеть внешнюю мембрану. Чаще всего для этого используют наноразмерные комплексы ДНК с липидными везикулами (липофекция), полимерными носителями или кристаллами кальция, которые сами поглощаются клеткой. Также можно временно продырявить мембрану с помощью электрического разряда — электропорации. Для случаев, когда ген нужно ввести лишь в несколько клеток (например, при изучении единичных нейронов), используют метод микроинъекции. В случае трансдукции используют вирусные частицы, в которые вместо части их собственного генома помещен необходимый ген. При этом вирусы сохраняют способность проникать в клетки, эффективно доставлять ген до ядра и, в случае некоторых вирусов, встраивать его в ДНК клетки.
Методы вирусной трансдукции имеют ряд преимуществ перед трансфекцией: высокая эффективность в отношении первичных клеточных линий, возможность встраивания гена в геном, применимость in vivo и избирательность действия вирусов на определенные типы клеток и тканей.
Для трансфекции создают искусственные вирусные частицы, снаружи похожие на натуральные вирусы и проникающие в клетку по тем же механизмам. Но внутри вместо части собственной ДНК они несут нужные исследователю гены и лишены программы саморепликации (то есть, такие частицы не заразны). Сегодня широко применяется около десятка генно-инженерных конструктов на базе различных вирусов. Для изменения избирательности вирусных частиц они могут быть дополнительно модифицированы заданными поверхностными молекулами.
Отредактируй это
Сейчас возможности клеточных технологий выходят на новый уровень после недавнего прорыва в методах редактирования генома на основе системы CRISPR/Cas-9. Методика уже активно используется, и в продаже имеются наборы для избирательного удаления определенных генов из клеток (генетический нокаут). Преимуществом CRISPR/Cas-9 является простота по сравнению с доступными прежде методами редактирования генома (цинковыми пальцами, TALEN). С помощью CRISPR/Cas-9 можно не только удалять и выключать гены, но и менять их и восстанавливать. На CRISPR/Cas-9 сегодня возлагают большие надежды в лечении моногенных наследственных заболеваний.
Да будет свет
Относительная простота введения желаемых генов в клетки открывает доступ к богатым возможностям, пожалуй, самого мощного на сегодня инструмента молекулярной биологии — генетически кодируемых флуоресцентных белков. Они позволяют отслеживать отдельные клетки в организме и даже молекулы в клетках, окрашивать определенные органеллы, изучать межмолекулярные взаимодействия и конформацию белков, измерять концентрации вторичных посредников (Ca2+, H2O2, цАМФ, H+, АТФ/АДФ, НАДН и др.), визуализировать и определять активность различных белков.
Помимо этого, в последние пять лет широкое распространение получила оптогенетика — метод, в котором с помощью генетически кодируемых светочувствительных белков можно управлять клеточными процессами с высоким временным и пространственным разрешением, буквально посветив в нужную область лазером (рис. 14).

Рисунок 14. Оптогенетические конструкции позволяют с помощью лазера в заданной точке клетки и в заданное время запускать всевозможные процессы: 1 — ток ионов через мембрану и электрические импульсы, 2 — активность генов, 3 — активность белков, 4 — активность рецепторов и передачу сигналов в клетки, 5 — поглощение веществ снаружи, 6 — взаимодействия между белками, 7 — перемещение внутриклеточных везикул, 8 — синтез и деградацию белков, 9 — дыхательную цепь митохондрий и гибель клетки, 10 — передачу сигнала вторичными посредниками.
Флуоресцентные белки и оптогенетика проявляют весь свой потенциал в связке с современными методами флуоресцентной микроскопии. Эти методы достигли чувствительности единичных молекул при пространственном разрешении в несколько десятков нанометров, а при временнoм — до нескольких десятков микросекунд (рис. 15). Хотя такое пространственное разрешение и ниже, чем у электронной микроскопии, наличие временнoго разрешения (то есть применимость к живым клеткам) и возможность анализировать одновременно несколько молекул делают методы оптической микроскопии уникальными для широкого круга задач.
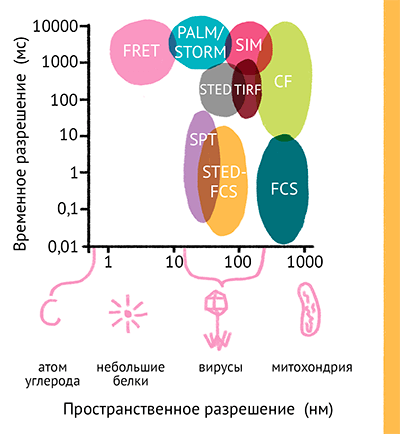
Рисунок 15. Пространственное и временнoе разрешение современных методов оптической микроскопии высокого разрешения. Обозначения: FRET — Forster resonant energy transfer (Фёрсторовский резонансный перенос энергии); SPT — single particle tracking (микроскопия траекторий единичных частиц); PALM/STORM — photoactivation localization microscopy/stochastic optical reconstruction microscopy (фотоактивированная локализационная микроскопия/микроскопия стохастической оптической реконструкции); STED — stimulated emission depletion (микроскопия подавления стимулированного испускания); FCS — fluorescence correlation spectroscopy (флуоресцентная корреляционная спектроскопия); TIRF — total internal reflection (микроскопия полного внутреннего отражения); SIM — structured illumination microscopy (микроскопия структурированного освещения); CF — confocal microscopy (конфокальная микроскопия).
Типирование и сортировка
Еще одним мощным методом, который применим только к клеткам in vitro и ex vivo (сразу после выделения), является проточная цитометрия — поштучное исследование клеток в потоке жидкости: клетки по одной проходят через луч лазера, а специальные детекторы ловят сигнал флуоресценции и светорассеяния от освещенной лазером клетки. В отличие от микроскопии, она является исходно количественным методом, то есть позволяет точно измерить интенсивность флуоресценции и обладает высокой производительностью: скорость обработки достигает миллиона клеток в минуту. Это позволяет проводить «перепись» гетерогенных клеточных популяций, коими являются все первичные клеточные культуры. В частности, ей нет альтернатив при идентификации, подсчете и сортировке редких в популяции клеток, таких как стволовые клетки или антиген-специфичные лимфоциты, которых может быть лишь несколько клеток на миллион. Наибольшее распространение цитометрия нашла в иммунологии для анализа субпопуляций лейкоцитов без перевода их в культуру. Важной разновидностью цитометрии является клеточная сортировка в потоке, которая позволяет не только анализировать, но и выделять отдельные субпопуляции из гетерогенных клеточных смесей с чистотой более 99%.
От клеток к организму с помощью стволовых клеток
До этого мы рассматривали традиционные методы работы с клетками, многие из которых предложены во второй половине прошлого столетия. В то время это были передовые технологии, которые впоследствии внесли существенный вклад в развитие биомедицинской науки и молекулярной биологии, а сейчас являются частью обыденной лабораторной практики. Сегодня передовые клеточные технологии позволяют достичь впечатляющих результатов. Однако в научных и, в особенности, научно-популярных статьях авторы часто склонны преувеличивать масштаб открытия и замалчивать сложности и ограничения. Это создает несколько искаженную картину, в которой уже сегодня где-то есть врачи, которые печатают органы на 3D-принтере, избавляют людей от ВИЧ и слепоты и способны вылечить практически любой рак. Действительно, успехи клеточных технологий позволяют надеяться, что это и правда станет возможным в будущем, но пока ведущие специалисты призывают не торопиться с прогнозами, поскольку организм и ткань гораздо сложнее, чем просто сумма составляющих клеток.
Эмбриональные стволовые клетки
В начале XX века Александр Максимов обнаружил, что клетки происходят от единого предка — стволовой клетки (СК). С того времени ученые постоянно искали СК в надежде научиться управлять их дифференцировкой и получать определенные ткани, а если повезет, то и органы. Было очевидно, что искать такие клетки нужно именно на ранних стадиях развития организма. Так, Хейфлик использовал абортивный материал, в котором, однако, клетки уже приобрели специализацию и пошли каждая по своему пути развития. Другие же брали эмбрионы животных и человека на более ранних стадиях в надежде получить стволовые клетки, которые еще не определились с направлением развития.
В первых экспериментах в 1970-х годах удавалось получить клетки, которые поддерживались в культуре как минимум год, но они существенно отличались от исходных клеток зародыша, не давали желаемой дифференцировки в клетки трех зародышевых листков и развивали хромосомные аномалии (то есть превращались в раковые). После нескольких лет оптимизации условий культивирования в начале 1980-х ученым удалось подобрать условия, обеспечивающие поддержание мышиных эмбриональных стволовых клеток (ЭСК) в недифференцированном состоянии. Потребовалось еще 17 лет экспериментов с ЭСК грызунов и приматов, прежде чем в 1998 г. удалось получить первые линии эмбриональных стволовых клеток человека (рис. 16). Для поддержания таких клеток в недифференцированном состоянии их выращивают на фидере — слое из эмбриональных фибробластов, убитых радиацией. На фидере ЭСК образуют характерные колонии, называемые эмбриоидными тельцами (рис. 16), а при его отсутствии — начинают спонтанно дифференцироваться, причем этот процесс с трудом поддается контролю.
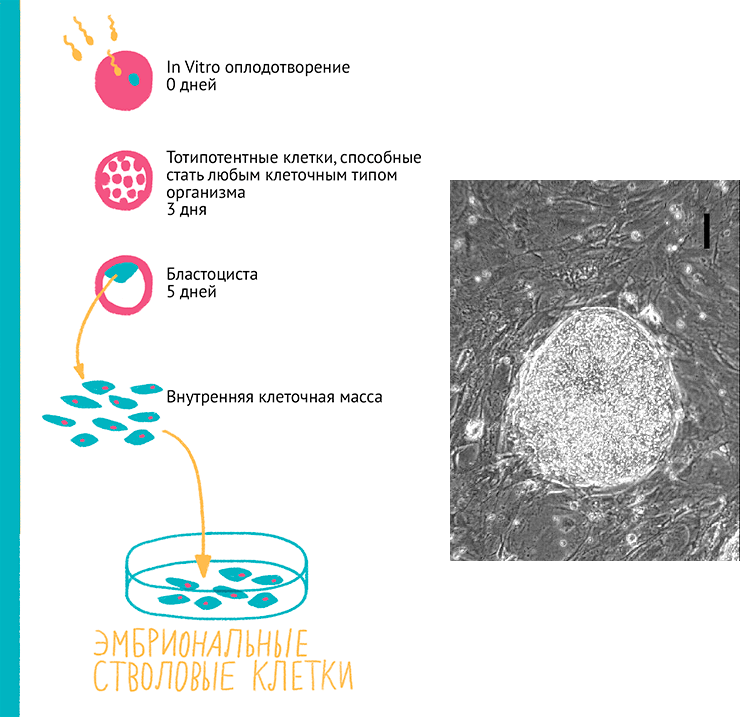
Рисунок 16. Схема получения и микрофотография колонии ЭСК. Эмбриональные клетки (~100 шт) получают на 5–9 день после экстракорпорального оплодотворения из внутренней клеточной массы бластоцисты. Эти клетки высаживают на фидер из умерщвленных фибробластов. Примерно через неделю можно обнаружить образованные ими колонии — эмбриодные тельца (справа).
Получение человеческих ЭСК дало ясную перспективу их использования в медицине и положило начало огромной волне исследований по управлению их дифференцировкой. Основной целью получения дифференцированных клеток из ЭСК является их использование для репарации поврежденных тканей. ЭСК также нашли широкое применение в фармакологии в качестве источника нормальных человеческих клеток разных типов для тестирования лекарств. Еще одна важная миссия ЭСК — вклад в понимание процессов дифференцировки, регенерации и репарации, что может быть использовано для активации собственного регенеративного потенциала организма.
Однако пока что терапия стволовыми клетками сопряжена с большим количеством проблем. Введение недифференцированных ЭСК в организм вызывает образование тератом (опухолей из всех типов ткани). Использование дифференцированных ЭСК тоже пока сопряжено с некоторыми сложностями, причем не только этического и юридического характера. Во-первых, эмбриональные стволовые клетки иммунологически не идентичны реципиенту, а значит, их подсадка вызывает иммунный ответ. Во-вторых, в культуре ЭСК часто присутствуют недодифференцированные клетки, которые при выведении могут вызвать образование опухолей. Эти проблемы поддаются решению путем тщательного отбора и очистки вводимого клеточного препарата, что, однако, существенно усложняет весь процесс. В-третьих, простое введение клеток не обеспечивает их правильной локализации в ткани, формирования полноценного внеклеточного матрикса и приобретения нужной активности. Терапевтический эффект от введения, безусловно, есть, но полного восстановления поврежденной ткани или утерянной функции достичь пока не удается.
Индуцированные плюрипотентные стволовые клетки
Грандиозным прорывом в области клеточных технологий после открытия ЭСК стала возможность перепрограммирования зрелых дифференцированных клеток организма в плюрипотентные стволовые клетки, названные индуцированными плюрипотентными стволовыми клетками (ИПСК, или iPSC, рис. 17). Не вдаваясь в детали получения ИПСК, отметим лишь их основные особенности:
- ИПСК получают без использования эмбрионов, что снимает множество этических ограничений.
- ИПСК можно получить от самого пациента, что позволяет обеспечить полную иммуносовместимость.
- Существуют протоколы получения ИПСК, в которых факторы перепрограммирования экспрессируются временно (не встраиваясь в геном), что снижает риск возникновения онкогенных мутаций.
- ИПСК генетически идентичны донору и могут быть использованы в качестве in vitro модели для изучения индивидуальных молекулярных механизмов патологии и для персонализированного подбора лекарств.
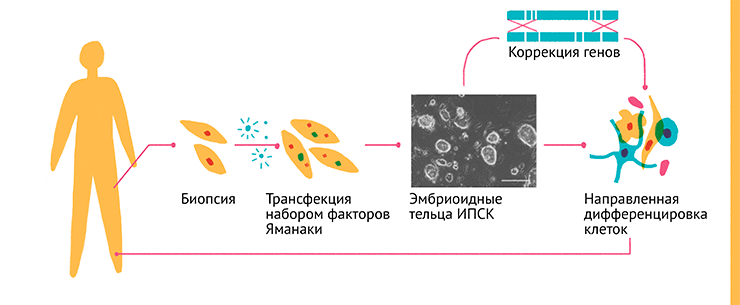
Рисунок 17. Схема получения и изображение эмбриоидных телец ИПСК. Клетки взрослого организма получают путем биопсии, после чего их трансфецируют набором транскрипционных факторов (факторов Яманаки) и высаживают на фидер. Для репрограммирования клеток и формирования эмбриодных телец необходимо 16 дней. После этого из ИПСК можно получать клетки заданного типа путем направленной дифференцировки и при необходимости корректировать неисправные гены. Полученные клетки могут быть использованы для введения пациенту с целью восстановления функций ткани.
Очевидно, что столь передовая технология на раннем этапе развития имеет множество сложностей технического характера. В оригинальной работе Такахаши и Яманаки эффективность репрограммирования клеток четырьмя «факторами Яманаки» составляла всего лишь 0,02%, а время образования колоний — 16 дней. При использовании аденовирусов, которые позволяют избежать модификации генома клеток, эффективность падала еще на порядок. Впоследствии исследователи в разных лабораториях сумели увеличить эффективность почти до 100% и ускорить образование колоний до 7 дней. Этого достигли за счет снижения стабильности генома, но остается вопрос, насколько безопасны такие модификации с точки зрения возможной онкогенной трансформации.
3D-культуры
Как уже было сказано, один из наиболее распространенных способов направленной дифференцировки ЭСК и ИПСК — формирование трехмерных эмбриоидных телец на фидере из фибробластов. Без фидера можно обойтись, если выращивать клетки в висячей капле, например, на крышке чашки Петри (рис. 18). Следует сказать, что такой метод был весьма распространен в начале и середине XX века для выращивания тканевых эксплантов и эмбриональных клеток, поскольку обеспечивал сохранность структуры ткани, длительность культивирования и удобство наблюдения с помощью прямого микроскопа. Наиболее распространенный подход такого культивирования был предложен все тем же Максимовым и заключался в использовании стекла с выемкой и двух покровных стекол. Для запуска дифференцировки телец в заданные ткани используют определенные наборы морфогенов и ростовых факторов, добавляемые по четкой программе, после чего клетки заключают в специальный гель, имитирующий внеклеточный матрикс (Matrigel). Оказалось, что стимулированные таким образом тельца обладают удивительной способностью воспроизводить характерную для целевой ткани трехмерную структуру (рис. 19), формируя органоиды. Они открывают уникальные возможность изучения механизмов формирования трехмерных тканевых структур, что практически невозможно с использованием животных. На сегодняшний день описано создание органоидов кишечника, мозга, печени, почки и молочной железы.
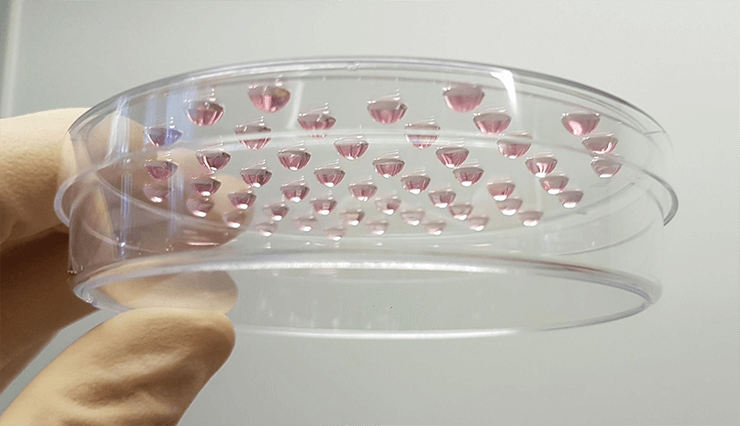
Рисунок 18. Стимуляция формирования эмбриоидных телец в подвешенных каплях.

Рисунок 19. Иммунофлуоресцентное окрашивание различных типов клеток на гистологическом срезе органоида кишечника.
ПРИМЕНЕНИЕ В БИОМЕДИЦИНЕ
Производство вакцин
Именно производство вакцин активизировало развитие клеточных технологий в 1950–1960-х годах. Первая вакцина, произведенная в линии клеток человека — против краснухи (1970 год). Для ее создания Стэнли Плоткин заражал клетки WI-38 вирусом и растил их при 30 °C, что позволило отобрать штамм вируса, приспособленный именно к этой температуре, а не к физиологическим 37 °C, при которых вирус погибал. Сегодня крупномасштабное производство вирусных частиц в клеточных линиях осуществляется в биореакторах, которые еще называют ферментерами (рис. 20 и 21).
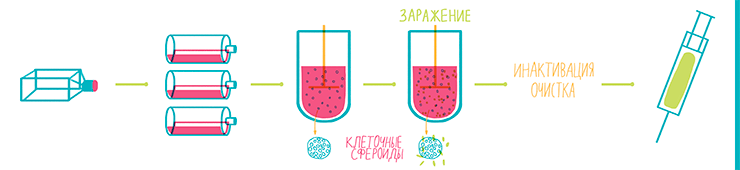
Рисунок 20. Схема технологического процесса производства вакцин. Для биореактора клетки из флакона сначала размножают, для чего обычно используют роллерные бутыли. С поверхности бутылей клетки в виде суспензии переносят в биореактор, где постоянно перемешивают, в результате чего они формируют клеточные сфероиды. Это позволят более эффективно использовать объем и питательную среду и многократно увеличить концентрацию вируса на литр среды. При достижении максимальной плотности клетки заражают вирусом, после чего они начинают его производить в большом количестве. Вирус собирают из культуральной среды, инактивируют, очищают и в итоге получают готовую вакцину.

Рисунок 21. Небольшой биореактор объемом 20 л, установленный на опытном биотехнологическом производстве ИБХ.
Биотехнологическое производство белков
Аналогично вирусам клетки могут производить и отдельные белки, но, в отличие от вирусов, белки не способны сами себя воспроизводить в клетках. Чтобы клетка начала производить нужный белок в нее необходимо внедрить ген этого белка. В этом заключается суть биотехнологического производства, при котором клетки программируются на генетическом уровне на выработку того или иного белка. Полученные таким образом белки называют рекомбинантными.
Сегодня наиболее распространенный тип клеток, используемый для производства рекомбинантных белков, — клетки бактерий, а именно кишечная палочка Escherichia coli (рис. 22). Преимуществами этих клеток являются: быстрая скорость размножения (около 30 мин), высокая плотность культуры, простой состав питательной среды и большое удельное количество производимого белка на клетку. Как следствие, бактерии обладают намного большей производительностью и меньшей конечной стоимостью продукта, по сравнению с остальными типами клеток.

Рисунок 22. Клетки для биотехнологии (электронные микрофотографии). Кишечная палочка Escherichia coli.
Бактерии, однако, способны правильно производить далеко не всякие белки. Дело в том, что конвейер по производству белков в бактериях существенно проще, чем у других, более сложных организмов. Во-первых, для сворачивания длинной полипептидной нити в правильную трехмерную форму в клетке присутствуют специальные помощники — шапероны, а у бактерий этих шаперонов меньше и они отличаются от эукариотических. Во-вторых, у бактерий отсутствует стадия пост-производственной доработки белков, на которой видоизменяются некоторые участки, навешиваются сахара и липиды и удаляются вспомогательные последовательности. В-третьих, многие белки (например, антитела) для правильного функционирования требуют объединения фактически нескольких белков (субъединиц) в один, а бактерии не могут этого сделать с чужеродными для них белками. И, наконец, высокая плотность нарабатываемого белка в бактериях является губительной для многих белков, и они выпадают в осадок. Это ограничивает использование бактерий лишь производством относительно простых белков.
Для производства сложных белков предпочтительно использовать клетки, наиболее похожие на те, которые производят их в естественных условиях. Так, для производства антител используют гибриды B-клеток (см. дальше). Для производства человеческих рекомбинантных белков сейчас используют несколько клеточных линий, условия культивирования и питательные среды для которых подобраны так, чтобы обеспечить максимальный выход продукта. Наиболее распространенной линией является линия клеток яичника китайского хомячка CHO, которая может расти как прикрепившись к поверхности, так и в суспензии. Вполне естественно, что за качество надо платить. Количество белка, получаемого из литра среды клеток млекопитающих, примерно в 10 раз ниже, чем из литра бактерий, а его производственная стоимость возрастает в десятки раз.
Некоторым компромиссом между клетками млекопитающих и бактериями являются дрожжи, которые почти так же быстро делятся, как и бактерии (~2 ч) и тоже не очень требовательны к питательной среде. Дрожжи, как и человеческие клетки, — эукариоты (имеют клеточное ядро) и обладают аппаратом, необходимым для полного цикла производства человеческих белков. Однако многочисленные мелкие отличия этого аппарата у дрожжей и млекопитающих требуют оптимизации процесса для каждого отдельного белка. Это, наряду с невысоким выходом продукта, делает дрожжи не самой распространенной биотехнологической системой. Другими возможными альтернативами клеткам млекопитающих являются клетки насекомых и растений.
Наибольшая часть разрабатываемых сегодня терапевтических препаратов — это рекомбинантные белки, и около 60% из них производится именно в клетках млекопитающих. В 2016 году из 10 лидирующих по суммам продаж препаратов 7 являются рекомбинантными белками, а 5 из них произведены в клетках CHO. В этом списке преобладают рекомбинантные антитела, что обусловлено относительной предсказуемостью их активности. В отличие от большинства других биологически активных молекул, антитела взаимодействуют только с одной мишенью, которую они связывают с исключительной избирательностью и прочностью, в результате чего просто ее «выключают». Стоит отметить, что выключение отдельной молекулы лишь инициирует биологический эффект, который развивается под влиянием множества факторов и остается во многом «черным ящиком». С этим связаны многочисленные противоречия в механизмах действия данных препаратов.
Получение рекомбинантных антител все еще довольно трудоемко, и поэтому для большинства задач антитела производят с помощью гибридoм.
Производство антител в гибридoмах
Антитела вырабатываются B-лимфоцитами в ответ на иммунизацию, то есть введение в организм антигена. Антитела можно выделить непосредственно из плазмы крови иммунизированного животного, которая содержит примерно 10 мг/мл антител. Антитела из плазмы крови называют поликлональными и широко применяют для научных исследований, однако для клинической диагностики они не годятся по двум причинам: 1) они не стандартизованы и 2) для клинической диагностики обычно нужна пара разных антител на один антиген. С целью получения таких стандартизованных антител необходимо выделить отдельные В-клетки, производящие антитела. Эти клетки выделяют из селезенки иммунизированной мыши, переводят в культуру и иммортализируют, сливая с клетками миеломы, получая гибридoмы (рис. 23).
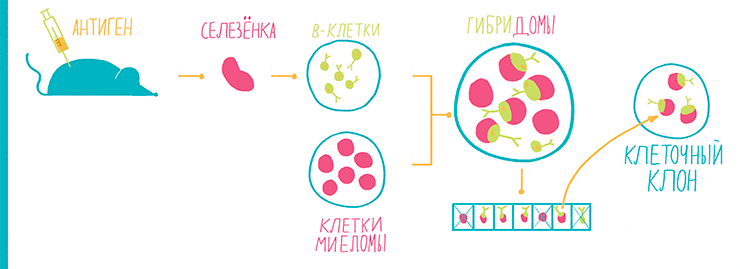
Рисунок 23. Схема процесса производства антител — гибридомная технология. B-клетки, производящие антитела, получают из селезенки иммунизированных мышей. Далее для наработки антител эти В-клетки необходимо размножить, но поскольку они имеют ограниченную способность к делению, их иммортализуют путем слияния с линией раковых клеток (миеломой). Клетки гибридом рассаживают по лункам планшета с сильным разведением для обеспечения попадания не более одной клетки в лунку. Далее выращивают потомков одной клетки — клеточный клон. Антитела, производимые клоном клеток, идентичны и называются моноклональными.
Клеточная терапия
Применение клеток в лечении — клеточная терапия — имеет довольно долгую историю. На своей заре эти методы не имели почти никаких юридических ограничений, поскольку применялись крайне редко, а научный прогресс существенно опережал законотворчество. Еще в XVII веке Жан-Батист Дени переливал кровь от овцы человеку. Гематология и по сегодняшний день является областью, где наиболее часто используют методы клеточной терапии. Точнее, преимущественно один метод — трансплантация кроветворных (гемопоэтических) СК после химиотерапии (рис. 24).
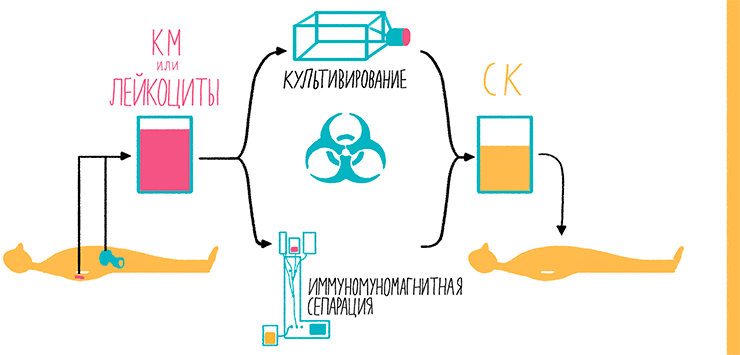
Рисунок 24. Схема трансплантации аутологичных (своих) кроветворных СК из костного мозга (КМ) и периферической крови. СК из периферической крови получают после предварительной стимуляции их выхода в кровоток из КМ, вводя препарат рекомбинантного белка (гранулоцитарный колониестимулирующий фактор). После этого путем афереза из крови отбирают небольшие ядросодержащие клетки. Эта процедура проводится в непрерывном режиме, при котором кровь из одной руки поступает в центрифугу, где расслаивается на фракции. Необходимая фракция отбирается, а остальные возвращаются обратно пациенту в другую руку. СК костного мозга получают из тазобедренных костей, прокалывая их в нескольких местах с помощью специальной иглы. При этом получают в общей сложности около 1 л суспензии. Кроветворные СК выделяют путем иммуномагнитной сепарации по маркеру CD34 или путем культивирования в специальных условиях. После проведения химиотерапии эти клетки вводят в кровоток для восстановления клеток крови.
Естественно, пересаживать пытались не только клетки крови, но и другие клетки, причем, в основном, от животных (ксеногенная трансплантация) или от других доноров (аллогенная трансплантация). В результате этих экспериментов появились случаи с летальным исходом, и в 1980-х годах клеточная терапия была запрещена в некоторых странах, а в других — обрела законодательные рамки. Запрет не коснулся хорошо зарекомендовавших себя подходов.
Широкое применение нашли мезенхимальные стволовые клетки (МСК), впервые открытые нашим соотечественником Александром Фриденштейном в 60-х годах прошлого столетия. МСК называют клетки соединительной ткани, способные дифференцироваться в клетки костной, хрящевой и жировой тканей (как обязательное условие, хотя и не только в них). МСК продемонстрировали высокую эффективность при регенерации указанных типов тканей, а также некоторых других. Стоит отметить, что регенеративный эффект МСК обусловлен не столько приживлением самих трансплантируемых клеток, сколько выделяемыми ими веществами и микрочастицами, которые стимулируют регенеративную активность собственных стволовых клеток. Такая особенность открывает возможность создания аптечной формы «лекарства» для активации регенерации на основе выделяемых МСК факторов.
Другим распространенным клеточным продуктом являются клетки пуповинной крови, которые содержат большое количество клеток на ранних стадиях дифференцировки и не успели накопить генетических ошибок. Эти клетки можно использовать вместо костного мозга, не нанося травму при выделении. Однако в протоколах для костного мозга необходимо больше клеток, чем есть в крови одной пуповины, что требует разработки специальных протоколов для клеток пуповинной крови. Сегодня ведется довольно много клинических исследований протоколов для лечения с помощью стволовых клеток неврологических, аутоиммунных, сердечно-сосудистых и наследственных заболеваний.
Одним из наиболее «горячих» направлений клеточной терапии является адоптивная клеточная иммунотерапия, при которой иммунные клетки программируются на распознавание и уничтожение опухолей. При этом в собственные иммунные клетки пациента in vitro вводят ген, обеспечивающий распознавание «ракового антигена» (молекулы, которой много на раковых клетках, но почти нет на нормальных). После генетической модификации клетки вводят обратно пациенту.
За распознавание антигена отвечают химерные рецепторы антигенов (chimeric antigen receptor, CAR) из-за чего метод называют CAR-технологией. Антиген в теории возможно подбирать индивидуально для каждого пациента, но пока используют некоторые более-менее универсальные для определенных типов опухолей антигены, например CD19 для B-клеточных лимфом. В настоящий момент ведутся клинические испытания около сотни CAR-технологий, а в июле 2017 года одобрение FDA (надзорного органа США по контролю оборота лекарств и пищевых продуктов) получила первая такая технология — для лечения B-лимфом модифицированными T-клетками, нацеленными против антигена CD19.
В России до 2012 года не было юридических норм для большинства технологий клеточной терапии, и разные государственные и коммерческие клиники проводили трансплантацию клеток на свой страх и риск. С 1 января 2017 года у нас вступил в силу закон «О биомедицинских клеточных продуктах». Этот закон регулирует использование только «клеточных линий», то есть стандартизованных клеточных культур, но не затрагивает минимально-манипулированные клеточные продукты. Последние отличаются тем, что при их получении отсутствует стадия культивирования клеток: это ЭКО, трансплантология, трансфузиология, пересадка костного мозга, кожи и т.д. Закон устанавливает правила донорства клеток, их регистрации и проведения клинических испытаний, а также накладывает обязательства по защите пациента. Естественно, что в данном законе детально не прописан регламент регистрации многих инновационных клеточных технологий, для чего сейчас разрабатывают соответствующие подзаконные акты.
В США в 2009 году был снят запрет на использование ЭСК в экспериментальной медицине, но сохранен запрет на государственное финансирование таких исследований (в том числе на использование оборудования, закупленного на государственные средства). В результате в США в 2015 году уже несколько клеточных продуктов на основе ЭСК проходили клинические испытания.
В отличие от США, в некоторых других странах клинические исследования ЭСК и ИПСК легализованы и имеют государственную поддержку. Такими флагманами клеточной терапии являются Япония, Израиль, Испания, Великобритания, Китай, Индия и некоторые другие. В настоящее время зарегистрировано около 20 клинических испытаний, в которых вводили клеточные продукты на основе ЭСК. Больше половины этих исследований использует полученные из ЭСК клетки сетчатки глаза для лечения возрастной слепоты (макулодистрофии). ИПСК на 10 лет «моложе» ЭСК и пока еще не дошли до этих стадий клинических испытаний в качестве методов терапии, но уже активно тестируются в качестве средств диагностики и для апробации лабораторных протоколов их получения и анализа.
Что имеем и чего ждать дальше?
Человек всегда стремился понять устройство живых организмов. Грандиозным шагом на этом пути стало открытие клеточного строения живой материи в XVII веке. Столетия последующих исследований только усложняли картину внутреннего устройства клетки и организма. Сегодня известны практически все клетки, составляющие человеческое тело, все белки и большая часть липидов и сахаров, составляющих клетку. Однако принципы организации и функционирования живых организмов остаются во многом непонятными. Помимо фундаментальных знаний исследования клеток дали множество прикладных технологий, таких как производство вакцин и антител, без которых сложно представить современную медицину. Технологии регенеративной медицины и клеточной терапии сегодня находятся на пороге массового практического применения в медицине.
Технический прогресс тесно связан с фундаментальными открытиям в биологии и медицине. Так, открытие клеточного строения живой материи стало возможным благодаря изобретению микроскопа. Технологии последних 10–20 лет сравнимы по значимости с этим открытием. Прежде всего, это методы получения и культивирования индуцированных плюрипотентных стволовых клеток, которые позволяют воссоздать (хотя и не полностью) процесс формирования органов in vitro. Немыслимые ранее возможности открывают и новые методы анализа клеток: оптическая микроскопия сверхвысокого разрешения, оптогенетика, высокопроизводительное секвенирование, масс-цитометрия и др. В совокупности это позволяет ожидать принципиально новых прикладных клеточных технологий и прорывов в понимании принципов организации живого, возможно, даже пересмотров фундаментальных основ биологии.
Источник: БИОМОЛЕКУЛА

