Терапевтические антитела — прекрасный пример реализации принципа таргетной терапии: к мишени — молекуле, играющей важную роль в развитии заболевания, — разрабатывается антитело, способное специфически связываться с ней. Но биотехнологии пошли дальше. Сейчас ведут активные разработки биспецифических антител, взаимодействующих одновременно с двумя молекулярными мишенями. Биспецифичность позволяет проявлять необычные биологические эффекты, связывая друг с другом молекулы, процессы и клетки.
Как устроено антитело
Антитела — это особые гликопротеины, имеющие Y-образную форму и довольно сложное строение (рис. 1). Они вырабатываются В-клетками (по-другому — B-лимфоцитами) и являются главным продуктом гуморального иммунитета, обеспечивая максимально специфическое «обезвреживание» чужеродных агентов — антигенов.
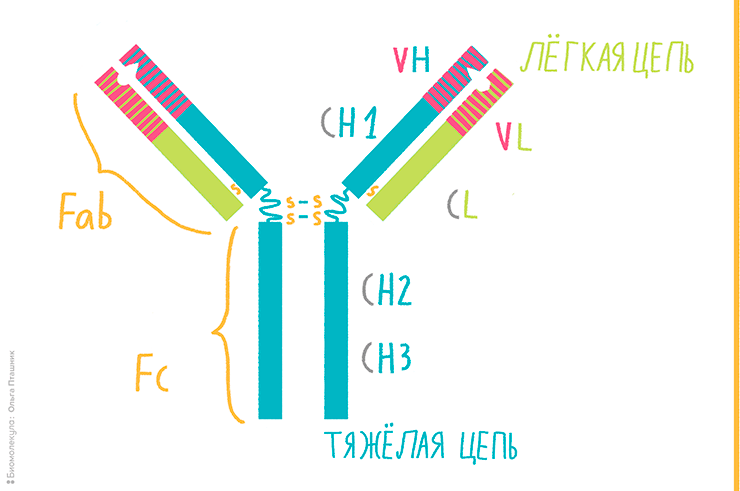
Рисунок 1. Строение Y-образного антитела. Оно состоит из двух зеркальных половин, соединенных дисульфидным мостиком.
Первые исследователи структуры антител, в частности, Родни Портер, столкнулись с проблемой сложности расшифровки аминокислотного состава этих белков, так как их размер превышал возможности применяемого в то время для секвенирования метода Сэнгера. Портер модифицировал этот метод, прибегнув к расщеплению антитела на фрагменты с помощью папаина (протеолитического фермента, полученного из «дынного» дерева — папайи). Папаин, разрушая шарнирные области, разделял антитело на принципиально различные в структурном и функциональном отношении фрагменты: один Fc-фрагмент и два Fab-фрагмента, роль которых — специфическое распознавание антигена.
Разделение антитела на функциональные части позволило со временем разрешить вопрос о том, как сочетается почти идентичное строение антител с их невероятной специфичностью. Действительно, бóльшую часть антитела занимают константные участки — консервативные по своей структуре домены, сходные друг с другом. Fc-фрагмент и часть Fab-фрагмента полностью состоят из таких доменов. Специфичность же антителу придают небольшие N-концевые участки в составе Fab-фрагмента (рис. 1).
Как работает антитело
Главными функциями Fab-фрагмента являются распознавание и связывание антитела с антигеном (рис. 2). В этом случае антитело способно напрямую воздействовать на клетку, провоцируя гибель по механизму апоптоза, или же действовать опосредованно, например, как при блокировании PD-L1. PD-L1 — молекула на поверхности опухолевой клетки, которая при взаимодействии с рецептором PD-1 на поверхности цитотоксических Т-клеток вызывает снижение их активности. Таким образом, блокируя путь, снижающий активность Т-клеток, мы стимулируем их к борьбе с опухолевыми клетками.
Fc-фрагмент выполняет не менее интересные функции (рис. 2).
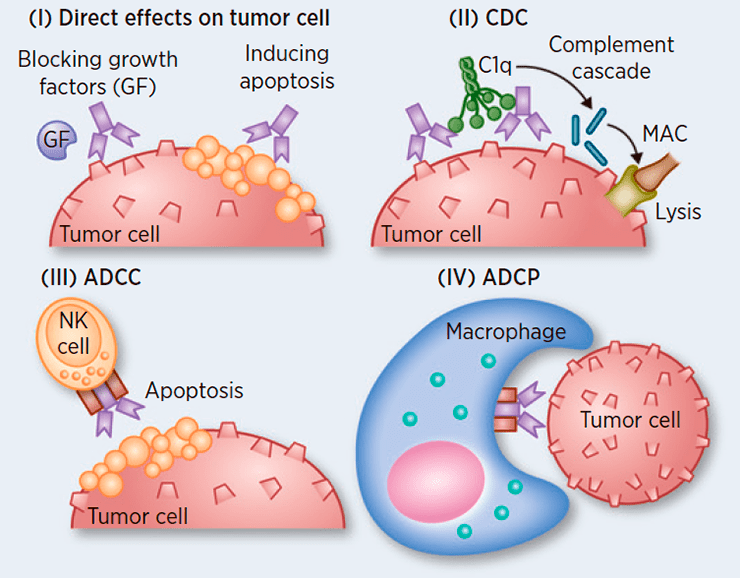
Рисунок 2. Процессы, опосредованные Fc-фрагментом. Антитела могут служить для привлечения иммунных клеток, убивающих клетки-мишени, а также для активации системы комплемента.
Так, с помощью Fc-фрагмента реализуется процесс антитело-зависимой клеточной цитотоксичности (antibody-dependent cell-mediated cytotoxicity, ADCC). Антитело с помощью Fab-фрагмента связывается с антигеном на поверхности, например, опухолевой или пораженной вирусом клетки, а с оставшимся свободным Fc-фрагментом взаимодействует NK-клетка (естественный, или натуральный, киллер). Вследствие этого NK-клетка оказывается в непосредственной близости от неугодной организму клетки, активируется и уничтожает ее.
Похожий «фокус» происходит в отношении, например, бактерий. Представьте себе мокрое мыло — его непросто поймать влажными руками; но достаточно посыпать мыло песком — и задача многократно упрощается. Подобным образом антитела могут «помечать» бактерии, связываясь с их поверхностными антигенами; а торчащие свободные антительные Fc-фрагменты связываются специальными рецепторами на поверхности макрофагов и прочих фагоцитов, которые успешно пожирают «захватчиков». Этот процесс называется антитело-зависимым клеточным фагоцитозом (аntibody-dependent cellular phagocytosis, ADCP).
Помимо процессов, связанных с привлечением клеток (NK, фагоцитов и т.д.), Fc-фрагмент способен активировать систему комплемента и способствовать цитолизу клеток путем образования мембранных комплексов, «дырявящих» клетки. Этот процесс носит название комплемент-зависимая цитотоксичность (complement-dependent cytotoxicity, CDC).
Биспецифические антитела можно использовать для осуществления всех этих механизмов. В то же время их «суперспособность» — одновременно распознавать два антигена — привносит дополнительные возможности.
Биспецифические антитела: умный иммунологический «конструктор»
Разработка методов производства моноклональных антител, внедрение их в медицинскую практику до неузнаваемости преобразило фарминдустрию. Моноклональные антитела стали своего рода воплощением идеи о «волшебной пуле», бьющей по мишени — молекуле, выключив которую (или наоборот, включив), можно вылечить болезнь. В качестве этой мишени часто выступает рецептор, расположенный на поверхности именно той клетки, которую нужно уничтожить.
Антитела обладают комплексным механизмом действия за счет своего сложного строения и «специализации» доменов. Генная инженерия позволяет использовать различные фрагменты антител в качестве «строительных блоков» конструктора, создавая из них уникальные по своим свойствам антитела. В большинстве биологических процессов участвует множество молекул-партнеров. Логичным этапом развития индустрии антител стало создание антител, распознающих сразу несколько мишеней. Как правило, этих мишеней две — таким образом, антитела являются биспецифическими.
Классические природные антитела — моноспецифические, однако при длительной пассивной иммунизации, а также при ряде заболеваний отмечено образование и биспецифических антител. Роль таких антител в природе до сих пор не ясна и активно изучается. Так, при аутоиммунном тиреоидите у части больных появляется биспецифическое антитело, которое связывается одновременно с тиреоглобулином и тиреоидной пероксидазой и выполняет, вероятнее всего, защитные функции, снижая активность системного воспаления.
По структуре биспецифические антитела принципиально разделяют на два типа (рис. 3): первые напоминают полноразмерные антитела (так называемые Y-образные биспецифические антитела), вторые же состоят, как правило, из одних только вариабельных участков, сшитых линкером. Важным отличием Y-образных антител является наличие Fc-фрагмента, который способен привлекать различные иммунные клетки или активировать систему комплемента, таким образом осуществляя рассмотренные выше механизмы иммунитета (ADCC, ADCP и CDC).
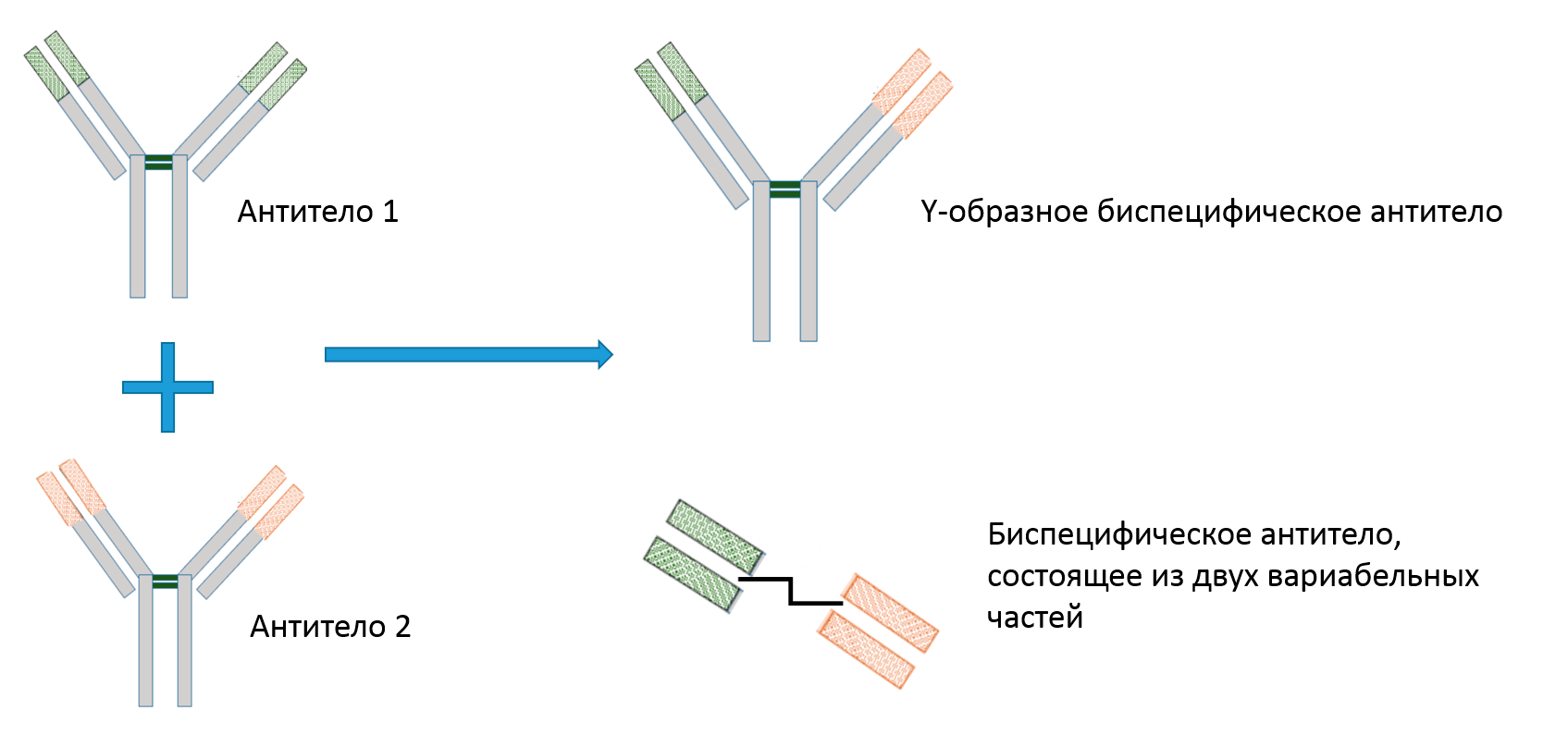
Рисунок 3. Два типа биспецифических антител: Y-образное и состоящее только из двух вариабельных доменов.
Для чего может пригодиться «стрельба» сразу по двум мишеням?
Один из вариантов применения биспецифических антител — привлечение (рекрутинг) иммунных клеток к интересующим нас клеткам: биспецифическое антитело выступает в качестве «мостика» между клеткой, выставляющей на поверхность мишень (как правило, это опухолевая клетка, подлежащая уничтожению), и иммунной клеткой. Например, таким образом можно привлекать к опухолевым клеткам NK-клетки, впоследствии убивающие их (рис. 4).
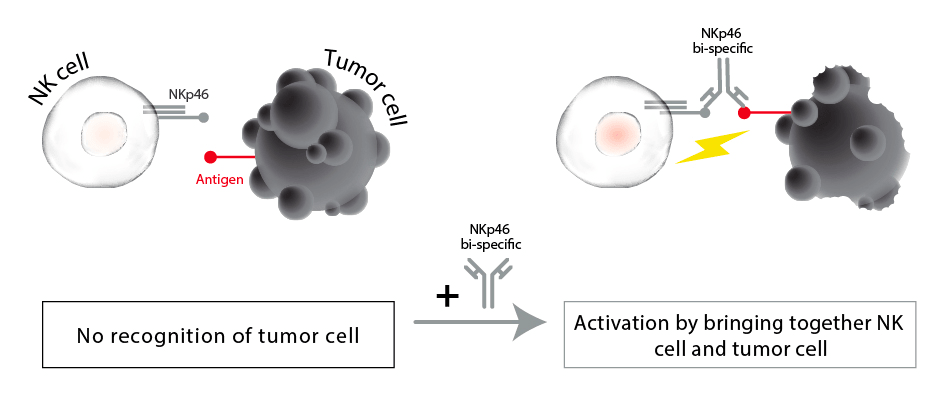
Рисунок 4. Принцип рекрутирования иммунных клеток. Биспецифическое антитело «привлекает» к клетке-мишени иммунную клетку (в данном случае натурального киллера, NK), которая уничтожает ее.
Другое применение биспецификов — мультиэпитопное таргетирование и мультитаргетирование (рис. 5). Оно заключается в конструировании биспецифических антител, способных связываться с различными эпитопами одного белка-мишени (что повышает аффинность связывания), либо с разными молекулами-мишенями на поверхности одной и той же клетки, одновременно блокируя два различных процесса. И тот, и другой подход значительно повышают «надежность» и специфичность действия антител.
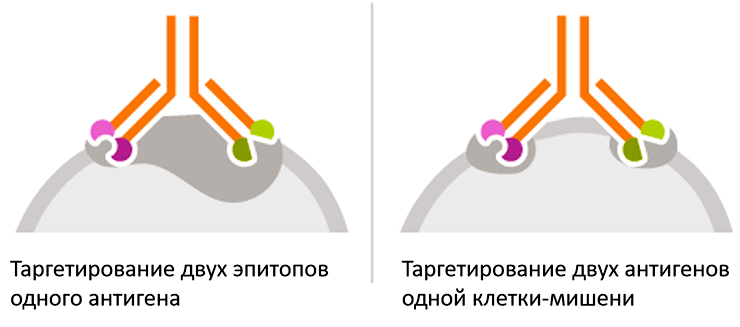
Рисунок 5. Мультиэпитопное таргетирование и мультитаргетирование с применением биспецифических антител. Биспецифическое антитело связывается с двумя эпитопами одного антигена (слева), либо с двумя мишенями на поверхности одной клетки (справа).
Существуют подходы, в которых используют исключительно антигенсвязывающие свойства антител. Биспецифические антитела могут применять для того, чтобы пространственно сблизить нужные клетки или факторы. Так, биспецифическое антитело анти-IXa—анти-X (эмицизумаб) способно димеризовать эти факторы, выступая в качестве искусственного лиганда при отсутствии природного (фактора VIII) у больных с гемофилией А (рис. 6).
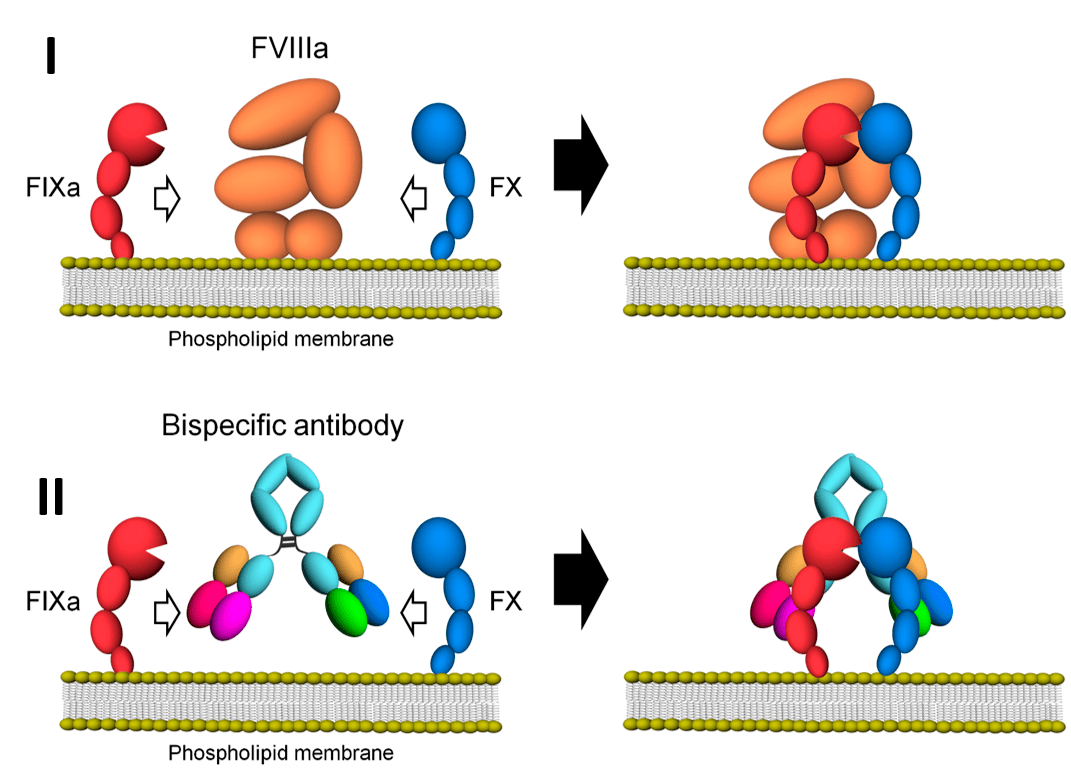
Рисунок 6. Биспецифическое антитело эмицизумаб имитирует фактор VIIIа, что используется при лечении гемофилии А. I — у здоровых людей фактор VIIIa участвует в димеризации факторов IXa и X, что необходимо для функционирования так называемого внутреннего пути свертывания крови. II — у больных гемофилией А наблюдается дефект фактора VIIIа. Биспецифическое антитело имитирует фактор VIIIа, связывая друг с другом факторы IXa и X.
Биспецифические антитела также используют в качестве транспортных агентов, с помощью которых можно преодолевать, например, труднодоступный для лекарственных препаратов гемато-энцефалический барьер (ГЭБ) (рис. 7).
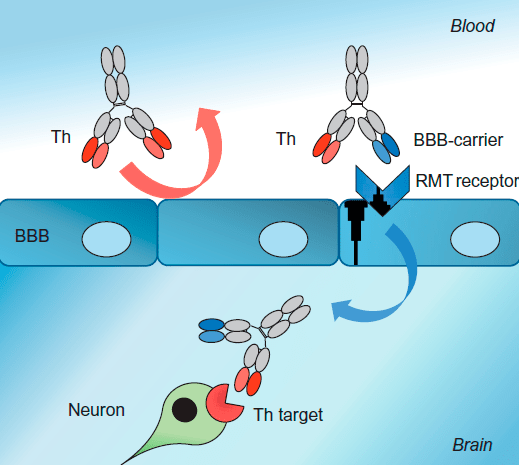
Рисунок 7. Биспецифические антитела, способные преодолевать гемато-энцефалический барьер. Биспецифическое антитело за счет одного своего вариабельного участка связывается с рецепторами, обеспечивающими преодоление ГЭБ, а за счет другого взаимодействует с мишенью на поверхности нейрона.
Все эти преимущества одновременного распознавания двух мишеней могут быть использованы в медицине.
Биспецифические антитела в клинической практике
Сейчас на разных этапах разработки находится более 60 биспецифических антител. Как и для прочих биотерапевтических препаратов, процесс этот крайне непрост, недешев и трудоёмок. Поэтому рассказы об иммунологических конструкторах с невероятными биологическими свойствами могут так и остаться рассказами без убедительных примеров успешных препаратов, добравшихся до реального клинического использования.
Рассмотрим два примера одобренных для применения в клинической практике биспецифических антител — катумаксомаба («Ремваба») и блинатумомаба («Блинцито»). Оба антитела относятся к так называемым рекрутерам иммунных клеток и используются в иммунотерапии опухолей. Катумаксомаб относится к Y-образным антителам, в то время как блинатумомаб — к антителам, состоящим из связанных друг с другом вариабельных доменов (рис. 3). На их примере можно продемонстрировать принципиальные различия между этими классами антител.
Катумаксомаб — гроза EpCAM-позитивных карцином
Катумаксомаб — анти-CD3—анти-EpCAM Y-образное антитело с одним анти-CD3 Fab-фрагментом, одним анти-EpCAM Fab-фрагментом и Fc-фрагментом. EpCAM (epithelial cell adhesion molecule) — трансмембранный гликопротеин, экспрессирующийся на поверхности некоторых карцином; а CD3 — молекула, присутствующая на поверхности Т-лимфоцитов. Антитело обеспечивает рекрутинг Т-клеток (в том числе цитотоксических CD8-лимфоцитов, убивающих опухоль) на экспрессирующие EpCAM клетки карциномы; оставшийся свободным Fc-фрагмент связывается с макрофагами или NK-клетками. Таким образом, клетка карциномы оказывается в окружении сразу нескольких популяций клеток, обладающих противоопухолевым эффектом (лизирующих и пожирающих ее) — CD8+ цитотоксических лимфоцитов, NK-клеток и макрофагов (рис. 8).
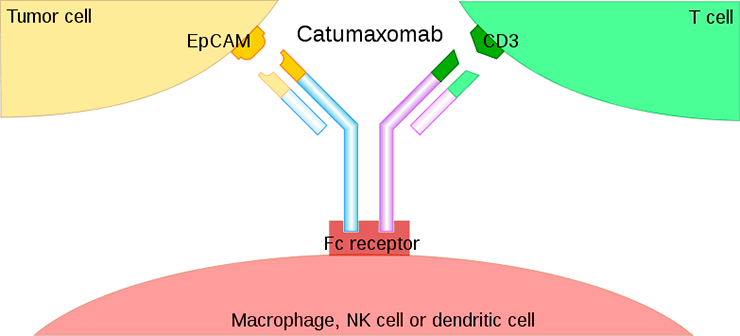
Рисунок 8. Строение и принцип действия катумаксомаба. Катумаксомаб — Y-образное биспецифическое антитело, привлекающее лимфоциты на EpCAM-экспрессирующие клетки карциномы. Противоопухолевый ответ усиливается за счет привлечения NK-клеток и макрофагов за счет Fc-фрагмента.
Катумаксомаб применяется для лечения EpCAM-позитивных карцином. Комплексный механизм действия приводит к достаточно эффективному уничтожению раковых клеток; вместе с тем, наблюдается развитие большого количества побочных эффектов, так или иначе связанных с избыточным воспалительным фоном. Для снижения серьезных побочных эффектов помимо классического внутривенного введения, разработаны подходы по введению антител в брюшную полость при соответствующей локализации опухоли.
Блинатумомаб — новое слово в лечении В-клеточных лейкозов и лимфом
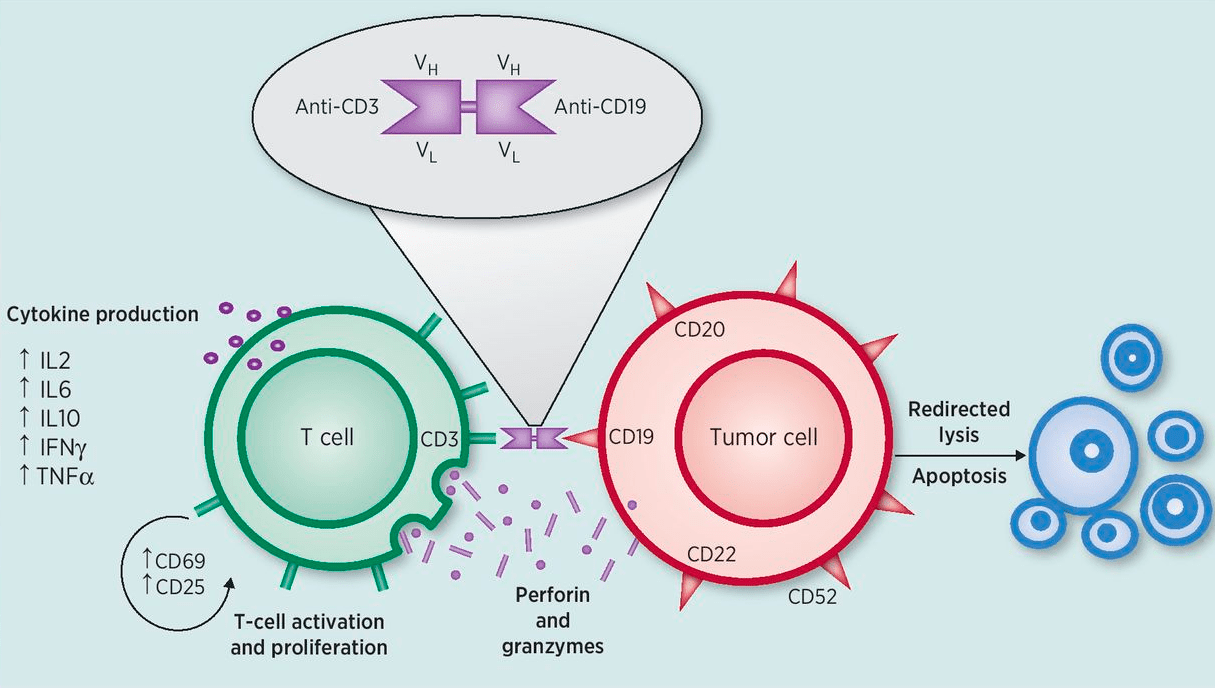
Блинатумомаб — биспецифическое анти-CD3—анти-CD19 антитело, рекрутирующее Т-клетки на В-клетки (рис. 9); препарат зарекомендовал себя при лечении рецидивов и рефрактерных форм В-клеточных злокачественных заболеваний, таких как В-клеточный острый лимфобластный лейкоз и неходжкинская лимфома.
Рисунок 9. Принцип действия блинатумомаба. Блинатумомаб — анти-CD3—анти-CD19 антитело, состоящее из двух анти-CD3 и двух анти-CD19 Fab-фрагментов, связанных друг с другом линкером. Блинатумомаб рекрутирует Т-клетки на В-лимфоциты, которые экспрессируют CD19. При этом образуется так называемая временная цитолитическая связь, приводящая к тому, что Т-клетки активируются и делятся. Активированные Т-лимфоциты уничтожают В-клетки по механизму «поцелуй смерти» с использованием перфорина, который «дырявит» мембрану В-клетки, и гранзимов, которые, проникая внутрь клетки, запускают апоптоз.
Современные стандартные протоколы химиотерапии обладают высокой эффективностью, однако случается, что после проведенного курса спустя некоторое время происходит «возвращение» болезни — рецидив, — или же проводимый курс оказывается изначально не эффективным (тогда заболевание называют рефрактерным по отношению к терапии). Опухолевые клетки в таких случаях закономерно будут обладать бóльшей устойчивостью к химиотерапии. Классически для борьбы с рецидивами и рефрактерными формами используют химиотерапию в более высокой дозе — так называемые противорецидивные курсы. В том случае, если не эффективны и они, прогноз на излечение крайне маловероятен. Именно на такой когорте сложных пациентов используют блинатумомаб в качестве «терапии спасения». Препарат показал настолько убедительно высокую эффективность, что клинические исследования по ряду патологий досрочно прервали. В исследовании, заключающемся в сравнении эффективности блинатумомаба по сравнению с химиотерапией у взрослых пациентов, блинатумомаб показал преимущество в частоте достижения, продолжительности ремиссии и общей выживаемости.
Вместе с тем, иногда бывает, что препарат все равно не эффективен, и происходит это благодаря явлению «ускользания» от таргетной терапии путем потери антигена (по-английски звучит эффектнее: escape — побег). Так, например, опухоль может потерять CD19 (по разным причинам) или из лимфобластного лейкоза превратиться в миелоидный (а миелоидные опухолевые клетки по умолчанию не экспрессируют CD19). Для решения этой проблемы на помощь могут прийти упомянутые выше биспецифические антитела анти-CD19—анти-CD22, таргетирующие два рецептора на поверхности одной и той же клетки — В-лимфоцита. Такой подход мультитаргетирования снижает вероятность развития рецидива путем потери антигена — вероятность потерять оба рецептора ниже, чем один.
Терапия с помощью лимфоцитов, несущих анти-CD19 химерный рецептор (CD19 CAR-Т лимфоциты)
Помимо блинатумомаба, для лечении В-клеточных злокачественных заболеваний в настоящее время используется еще один вид таргетной иммунотерапии — клеточная терапия с помощью CD19 CAR-Т-лимфоцитов (рис. 10).

Рисунок 10. Принцип действия блинатумомаба и CD19 CAR-T-лимфоцитов.
CD19 CAR-T — Т-лимфоцит с химерным рецептором, распознающим CD19. Принцип подхода заключается в использовании собственных (аутологичных) Т-клеток пациента, экспрессирующих генно-инженерный рецептор, сочетающий в себе scFv-часть от моноклонального антитела с заданной специфичностью и внутриклеточную сигнальную часть от Т-клеточного рецептора, его CD3ζ-цепи. В использующихся сегодня CD19 CAR-T-клетках в структуре внутриклеточного домена также используют дополнительный костимуляторный домен, заимствованный от физиологических костимуляторных молекул CD28 или 4-1BB, для полной активации CAR-T-клеток при взаимодействии с клеткой-мишенью. И блинатумомаб, и CD19 CAR-T в качестве мишени используют рецептор CD19 на поверхности В-клетки; и в том, и в другом случаях используют аутологичные Т-лимфоциты. Создание CAR-T-клеток — довольно трудоемкий процесс, заключающийся в отборе Т-клеток из периферической крови, введении в них генетических конструкций, несущих химерный рецептор, проверке эффективности и безопасности и введении клеток обратно пациенту. Таким образом, терапия CAR-T-клетками является своего рода генной терапией ex vivo. В отличие от этого, блинатумомаб действует внутри организма, то есть in vivo.
CD19 CAR-T-клетки, также как блинатумомаб, показали впечатляющую эффективность при лечении В-клеточного острого лимфобластного лейкоза. Стоит отметить, что прямых исследований по сравнению эффективности блинатумомаба и CD19 CAR-T не существует.
Выбор мишеней при разработке биспецифических антител
Ключевую роль в разработке биспецифического антитела играет грамотный выбор мишеней. Чтобы эффективно связывать две клеточные популяции/структуры/процесса, антителу необходима надежная пара мишеней для «зацепки». Кроме этого, мишень должна специфично, устойчиво и на достаточном уровне присутствовать на поверхности интересующей нас клеточной популяции, а также участвовать в интересующем нас процессе.
Разберем логику подбора мишеней на примере блинатумомаба, о котором шла речь в предыдущем разделе. Блинатумомаб «натравливает» клетки иммунитета на злокачественные клетки при В-клеточном лейкозе или лимфоме. В процессе разработки, таким образом, стояло две главных задачи: выбор популяции иммунных клеток, которые бы убивали опухолевые клетки, и выбор надежной мишени на поверхности В-клеток.
Итак, первая задача. Важно, чтобы иммунные клетки обеспечивали цитолиз опухолевых клеток за счет естественных свойств, чтобы происходила активация и экспансия этих клеток, не лишней была бы и возможность образования пула клеток памяти. Предъявленным требованиям удовлетворяют лимфоциты CD8+. Для рекрутинга выбрали надежный, синтезирующийся на хорошем уровне поверхностный маркер CD3. CD3 является пан-Т-клеточным рецептором, то есть его производят все Т-лимфоциты, и при применении биспецифического антитела к опухолевым клеткам будут привлекаться различные субпопуляции Т-клеток. Однако большинство этих популяций не будут значительно влиять на исход терапии. Единственной популяцией CD3+ клеток, которая может доставить некоторые трудности, являются регуляторные T-клетки, обладающие иммуносупрессивными свойствами. Поэтому для эффективного применения блинатумомаба необходимо, чтобы содержание этих клеток перед началом курса не было выше определенного уровня.
Вторая задача — выбор маркера-мишени на поверхности опухолевой В-клетки. Выбор сделали в пользу рецептора CD19, который хорош тем, что устойчиво и равномерно синтезируется во всех клетках В-лимфоцитарного ряда (в том числе и опухолевых).
Существенным плюсом такого выбора является и то, что CD19 практически нигде, кроме В-клеток, не синтезируется и, соответственно, терапия специфична. Но есть и минус — антитело уничтожает все В-клетки, и на некоторое время организм оказывается без В-клеточной иммунной защиты. В клинической практике, однако, это не является неразрешимой задачей — врачи внутривенно вводят пациентам иммуноглобулин.
Механизм действия блинатумомаба предполагает, что между Т- и В-клетками должен образоваться «мостик»: в результате взаимодействия лимфоцитов Т-клетка активируется и начинает пролиферировать. Для развития такого сценария анти-CD19-конец биспецифического антитела сделали более высокоаффинным, чем анти-CD3-конец. Пролиферация активированных Т-клеток обеспечивает необходимый иммунный «фон». Активированные клетки циркулируют по организму в поисках В-клеток, находят и уничтожают их за счет естественных механизмов, кроме того, в этом им помогает продолжающий поступать в организм блинатумомаб (препарат вводят продолжительное время непрерывной инфузией).
Новые терапевтические биспецифические антитела
Первые успехи по применению биспецифических антител в клинике, в особенности блинатумомаба, который часто называют «прорывом» в терапии В-клеточных злокачественных заболеваний, стали своего рода доказательством состоятельности и эффективности данного подхода. Сейчас разрабатывают множество новых биспецифических антител, которые потенциально могут стать прорывными в своих нишах. Приведем пару примеров:
AFM13 — биспецифическое антитело анти-CD30—анти-CD16A, рекрутирует NK-клетки на злокачественные клетки, экспрессирующие CD30, например, при ходжкинских лимфомах. Кроме цитотоксического противоопухолевого действия в реальном времени (пока вводится препарат), показано образование пула NK-клеток, напоминающих Т-клетки памяти. NK-клетки памяти могут быть крайне полезны для предотвращения рецидивов, «патрулируя» организм и выискивая CD30+ клетки уже после завершения введения антитела.
Навициксизумаб (OMP-305B83; анти-DLL4—анти-VEGF) способен эффективно подавлять опухолевый ангиогенез — патологический чрезмерный рост сосудов. Часть анти-DLL4 блокирует Notch-сигнальный путь, критически важный для опухолевого ангиогенеза. В экспериментах замечено, что в ответ на блок Notch-сигналинга происходит компенсаторное повышение продукции фактора роста сосудов VEGF, что представляет собой хитрый «ход» опухоли, существенно снижающий эффективность антиангиогенной терапии. Но ход этот можно блокировать, именно для этого вторая часть навициксизумаба направлена против VEGF.
Новые биспецифические антитела разрабатывают не только в области онкологии. Так, для терапии остеопороза разработано биспецифическое антитело, связывающееся с двумя факторами-трансдукторами Wnt-сигнального пути — клеростином и Dkk1 (пример подхода мультитаргетирования одного процесса). Использование антитела активирует функцию остеобластов, стимулируя рост и укрепление кости.
Разрабатывают антитело-кандидат для лечения болезни Альцгеймера. Оно способно связываться с трансферриновым рецептором, что позволяет ему преодолевать ГЭБ, и протеазой BACE1, которая аккумулирует амилоидный пептид.
Также ведут разработки биспецифических антител для лечения аутоиммунных заболеваний. Показано, что связывание двух различных цитокинов с помощью биспецифического антитела может быть более эффективным, чем применение двух моноклональных антител к этим же мишеням. В частности, хорошим клиническим эффектом в отношении ревматоидного артрита и псориатического артрита показал препарат ABT122, анти-TNF—анти-IL17A антитело.
Обороты терапевтических моноклональных антител составляют около 60 миллиардов долларов в год. По данным за 2017 год, продажи биспецифического антитела блинатумомаба составили 175 млн долларов. Согласно оценкам, за ближайшие пять лет они вырастут более чем в три раза и к 2023 году составят 544 млн долларов.
Подбирая различные пары мишеней, регулируя аффинность и взаимное расположение вариабельных участков, а также способ их связывания, можно сконструировать множество биспецифических антител. Но пусть читатель не соблазняется кажущейся простотой: разработка биспецифического антитела — очень сложная задача.
Источник: БИОМОЛЕКУЛА