Вирофаги — это небольшая группа вирусов, которые могут размножаться в эукариотических клетках только вместе с другим вирусом-хозяином, используя его «фабрику» для производства собственных частиц. Известные на данный момент вирофаги паразитируют на гигантских вирусах, в частности мимивирусах, которые, в свою очередь, инфицируют клетки амёб. Используя ферменты вирусов-хозяев для образования своих частиц, вирофаги сильно портят им жизнь, мешая формированию вирионов и протеканию инфекционного цикла. Недавно было показано, что мимивирусы не так уж и беззащитны перед вирофагами: у них есть особая молекулярная машина, получившая название MIMIVIRE. Первоначально было заявлено, что по механизму работы MIMIVIRE очень напоминает систему CRISPR/Cas прокариот, направленную на защиту от вирусов и плазмид. Впрочем, история с MIMIVIRE куда более темная, чем кажется на первый взгляд...
Схема, иллюстрирующая возможное сходство систем CRISPR/Cas и MIMIVIRE
Вирофаги: вирусы вирусов
Первый вирофаг был описан в 2008 году. С помощью электронной микроскопии в клетках амёб, зараженных мамавирусом (гигантским представителем семейства мимивирусов), а точнее, в его вирусных фабриках — особых зонах цитоплазмы, где происходит активная сборка вирусных частиц, — были обнаружены маленькие вирионы диаметром около 50 нм. Оказалось, что в амёбах с такой двойной инфекцией вирионы мамавируса часто имеют неправильную морфологию. Кроме того, в таких клетках образуется на 70% меньше мамавирусных вирионов, чем в клетках без загадочного маленького вируса. Зато маленький вирус может размножаться в клетках амёб только в присутствии мамавируса, почему и получил название Спутник.
С тех пор было описано еще несколько вирофагов. Например, мавирус, размножающийся за счет вируса CroV в морском простейшем Cafeteria roenbergensis, и вирофаг Замилон (в переводе с арабского — «сосед»), жизненный цикл которого протекает в амёбах, зараженных мимивирусами (рис. 1). В отличие от Спутника, который может паразитировать на любых мимивирусах, Замилон использует для размножения только мимивирусы групп B и C, а группа A к нему устойчива.
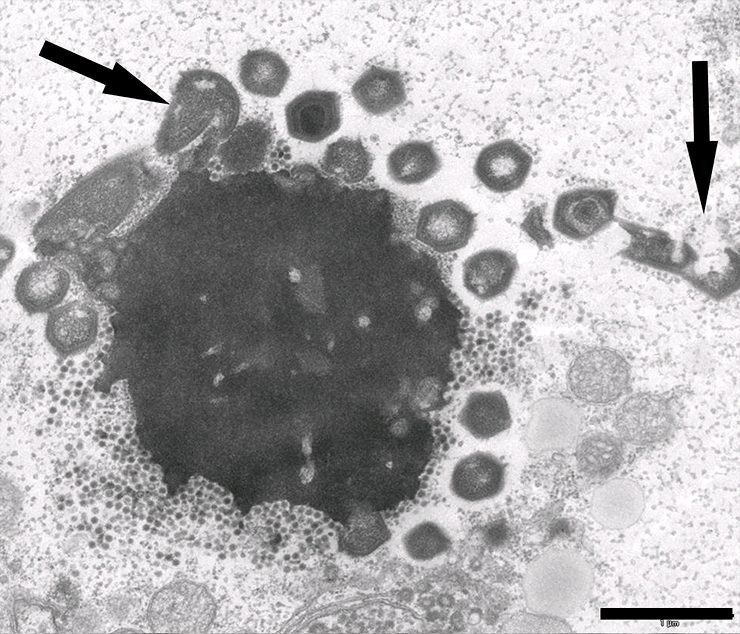
Рисунок 1. Электронная микрофотография вирусной фабрики в клетке амёбы, зараженной мимивирусом и вирофагом Замилон. Стрелки указывают на дефектные частицы мимивируса (масштабная линейка — 0,1 мкм).
CRISPR/Cas: врожденный иммунитет прокариот
Около половины бактерий и 80% архей обладают удивительной системой приобретенного иммунитета к бактериофагам и плазмидам, которая получила название CRISPR/Cas (от англ. Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR-associated proteins). При первом вторжении вируса в прокариотическую клетку белки этой системы отрезают от его ДНК маленький кусочек, протоспейсер, который вставляется в клеточный геном. Протоспейсер внедряется между короткими палиндромными повторяющимися последовательностями ДНК и переименовывается в спейсер. Если впоследствии в клетку или ее потомство снова проникнет тот же вирус, то с соответствующего спейсера «считается» РНК, комплементарная ДНК этого вируса. Она свяжется с фаговым геномом, а распознающие образовавшийся комплекс Cas-белки разрушат чужеродный генетический материал.
Но РНК может с таким же успехом комплементарно связываться и со «своим» спейсером, то есть частью генома клетки, и если такой комплекс будет распознаваться разрезающими белками, то клетка просто измельчит участок собственного генома и погибнет. Так как же достигается специфичное разрушение комплексов РНК только с ДНК вируса? Оказывается, для разрезания комплементарных молекул одного только спаривания с РНК недостаточно. Чтобы белки Cas сумели распознать комплекс как подлежащий разрушению, в ДНК-мишени по соседству с протоспейсером должна быть специальная короткая последовательность PAM (от англ. Protospacer Adjacent Motif). Рядом со спейсером в геномной ДНК прокариот PAM нет, что и защищает ее от разрушения Cas-белками.
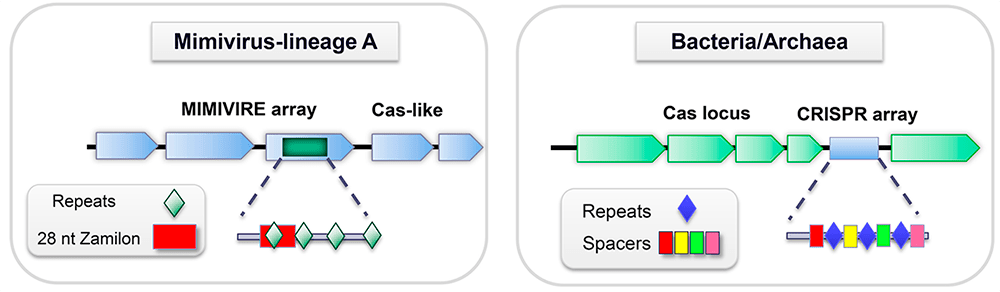
MIMIVIRE: неужели у мимивирусов есть нечто подобное CRISPR/Cas?
В 2016 году на страницах журнала Nature группа французских ученых сообщила об удивительном наблюдении. Как мы помним, вирофаг Замилон поражает только мимивирусы групп B и C, но не А. Оказалось, что у мимивирусов последней группы в геноме присутствуют четыре повторяющихся 15-нуклеотидных фрагмента ДНК Замилона — подозрительно похоже на спейсеры в системе CRISPR/Cas (рис. 2). Они входят в состав особой генетической системы, которая получила название MIMIVIRE (от англ. MIMIvirus VIrophage Resistant Element). Интересно, что единичные копии фрагментов ДНК Замилона находят и в геномах некоторых представителей групп B и C, однако для обеспечения резистентности, по-видимому, их недостаточно. Вставленный в геном мимивируса участок ДНК Замилона берется из ORF4, кодирующей белок, родственный транспозазе А — ферменту, который катализирует перемещение транспозонов по геному. (Примечательно, что у Спутника, способного поражать самые разные мимивирусы, подобного гена нет.) Сама же система MIMIVIRE находится в составе мимивирусного гена R349. При этом белковые продукты соседних генов демонстрируют некоторое сходство с белками Cas.
Рисунок 2. Сравнение систем MIMIVIRE и CRISPR/Cas. Слева — система MIMIVIRE с последовательностями, происходящими из генома Замилона, справа — система CRISPR/Cas со спейсерами, показанными разными цветами.
Ученые решили подтвердить напрашивающуюся аналогию экспериментальными данными. Что будет, если с помощью РНК-интерференции отключить MIMIVIRE? Как это скажется на резистентности мимивирусов группы А к вирофагам?
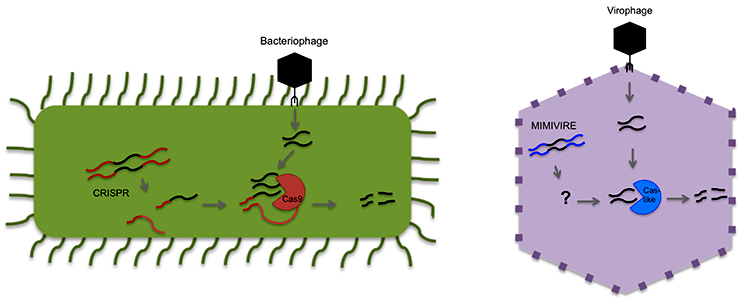
Оказалось, что отключение и самогό гена R349, содержащего вставки ДНК Замилона, и соседних генов, похожих на Cas, многократно увеличивает количество ДНК вирофага в зараженных клетках. В случае отключения R349 — аж в 65 раз! Напрашивается вывод, что устойчивость мимивирусов группы А к Замилону действительно обеспечивается системой MIMIVIRE, работающей по аналогичному с CRISPR/Cas принципу: в мимивирусный геном вставляются участки ДНК вирофага, далее с них считывается РНК, комплементарно взаимодействующая с геномом вирофага, который затем разрушается белками, похожими на Cas. Так вирофаг лишается шансов на успешное размножение за счет вируса-хозяина.
Почему MIMIVIRE всё-таки не аналог CRISPR/Cas
Несмотря на всю привлекательность предположения, что мимивирусы защищаются от вирофагов с помощью системы, похожей на CRISPR/Cas, оно не может ответить на ряд вопросов и упирается в логические тупики.
Во-первых, как система MIMIVIRE может отличить «свое» от «не своего» — ДНК вирофага, от которой нужно отрезать кусочек и вставить в геном мимивируса, от ДНК самого мимивируса? Цена ошибки в данном случае очень велика: если система вставит в геном мимивируса фрагмент мимивирусного же генома, то белки разрежут эту вставку. Для мимивируса это кончится весьма плачевно, поскольку все его новосинтезированные копии будут уничтожены. Как назло, геномы мимивируса и вирофага реплицируются на одной и той же вирусной фабрике и практически не различаются по GC-составу. Теоретически система MIMIVIRE могла бы отличить свою ДНК от вирофаговой, если бы темпы их репликации сильно различались — например, как в случае геномной ДНК бактерии и плазмиды. Однако свидетельств в пользу подобного различия нет, поэтому пока не понятно, как обеспечивается специфичность работы MIMIVIRE.
Во-вторых, как система MIMIVIRE может отличить уже вставленную в геном мимивируса последовательность ДНК Замилона от такой же последовательности в составе вирофага? Ведь, опять же, по ошибке могут быть разрезаны копии мимивирусной ДНК. Как мы помним, система CRISPR/Cas решает эту проблему узнаванием PAM, которые есть только в ДНК, подлежащей разрушению (то есть возле протоспейсеров, но не спейсеров). В случае MIMIVIRE элементов, подобных PAM, нет. Более того, фланки предполагаемых «спейсеров» и «протоспейсеров» могут вообще совпадать (рис. 3).
В-третьих, система MIMIVIRE, по-видимому, не имеет жесткой структуры, характерной для всех мимивирусов группы А. Более того, у мимивирусов групп B и C ген R349 имеет совершенно другую последовательность (менее 35% идентичности) или сильно усечен. Прокариотический локус CRISPR, в который внедряются протоспейсеры, имеет четкую консервативную структуру: сначала идут гены белков Cas, потом — особая лидерная последовательность, а за ней — длинный ряд повторяющихся последовательностей, между которыми находятся спейсеры. Даже если принять на веру, что короткие последовательности, вставленные в MIMIVIRE, действительно заимствованы у Замилона, а не просто имеют случайное сходство с ним, то механизма для их целенаправленной и жестко контролируемой интеграции в геном мимивируса нет.
Альтернативный механизм работы MIMIVIRE
Если принципиальное сходство между MIMIVIRE и CRISPR/Cas сомнительно, то как же тогда можно объяснить результаты экспериментов по отключению MIMIVIRE? Была предложена альтернативная модель работы системы MIMIVIRE, в которой главная роль отводится не комплементарному взаимодействию нуклеиновых кислот, а белок-белковым взаимодействиям. Выяснилось, что все четыре предполагаемые вставки ДНК Замилона находятся в одной мимивирусной рамке считывания, поэтому белок, кодируемый геном R349, содержит четыре повторяющиеся аминокислотные последовательности вида «аспартат — аспарагин — глутамат — серин», или DNES, если использовать однобуквенные обозначения аминокислот (рис. 3). Однако у мимивирусов групп B и C гомологов DNES-содержащего белка R349 нет, как нет их и у Спутника — вирофага, способного размножаться во всех мимивирусах. По-видимому, для того чтобы защитный механизм сработал, белки с мотивами DNES должны быть и у мимивируса, и у вирофага. Последовательность DNES соответствует гидрофильной гибкой петле, которая, вероятнее всего, находится на поверхности белка и потому участвует в белок-белковых взаимодействиях. Если предположить, что для успешной репликации Замилона необходимо взаимодействие белка ORF4, содержащего мотив DNES, с каким-то другим белком, тоже имеющим этот мотив, то мимивирусный DNES-содержащий R349 может конкурентно подавлять этот процесс, оттягивая на себя весь ORF4 и не давая ему связаться с предполагаемым белком-мишенью. Если же отключить ген R349, то конкурентое подавление будет нарушено, и репликация вирофага продолжится. Именно это, как мы помним, и показал эксперимент с РНК-интерференцией.
Рисунок 3. Последовательности генов и белковых продуктов ORF4 Замилона и R349 мимивируса. Зеленым цветом выделена «замилоновая» последовательность длиной 15 нуклеотидов, якобы вставляющаяся в геном мимивируса, а идентичные или почти идентичные фланкирующие последовательности выделены пурпурным. Голубым цветом выделены последовательности DNES, причем в белке R349 они входят в состав не только предполагаемых вставок, но и их фланков. Мотивы, похожие на DNES, выделены желтым. С-концевая часть R349 не показана.
Итак, система MIMIVIRE, судя по всему, действительно участвует в защите мимивируса от вирофага Замилон, однако предполагаемый механизм ее работы еще предстоит подтвердить экспериментально.
Источник: БИОМОЛЕКУЛА