Одна из причин старения заключается в укорочении хромосомных «хвостов» – теломер. Так называют концевые участки хромосом, в которых не закодировано никакой генетической информации и задача которых состоит в том, чтобы защищать остальную хромосому от повреждений.
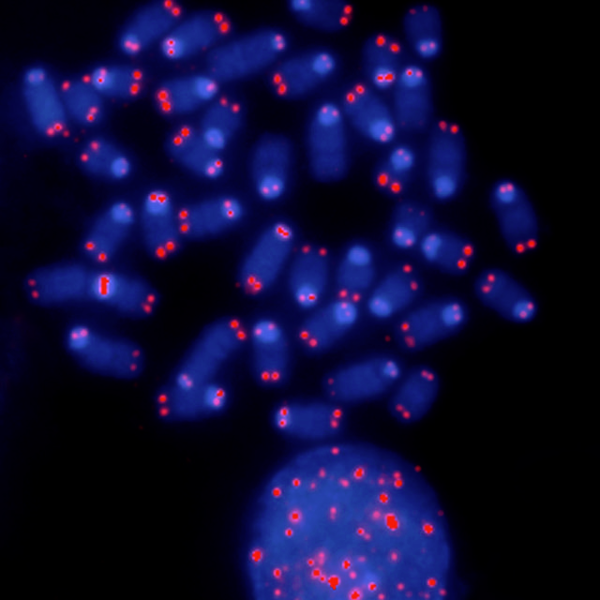
Хромосомы с окрашенным красным теломерами; некоторые хромосомы успели лишиться теломер.
Как мы знаем, при делении клетка удваивает (реплицирует) всю свою ДНК, чтобы каждой дочерней клетке досталось по копии генома. Молекулярные машины, занимающиеся репликацией ДНК, не могут дочитывать её до конца, так что при каждом делении каждая хромосома теряет небольшой концевой кусочек. Если бы на самом конце сидел какой-нибудь нужный ген, то он просто бы испортился и клетка вряд ли бы выжила. Однако на хромосомных концах сидят «бессмысленные» теломеры, так что клетки могут свободно делиться, не боясь генетических повреждений. Но со временем теломеры становятся всё короче и короче, и вот тут начинаются проблемы.
Дело в том, что теломера – это не просто «хвост», это «хвост с завитком». На самом конце теломеры формируется довольно сложная петлеобразная структура, и формируется она только тогда, когда сама теломера достаточно длинна. Петля служит своеобразным предохранителем, защищающим хромосому от повреждений.
В какой-то момент теломера укорачивается настолько, что никакой петли у неё уже не получается. В таком виде хромосома выглядит, как будто она просто разорвалась и молекулярные машины, которые следят за целостностью генома, расценивают отсутствие петли как тяжёлую, не подлежащую ремонту мутацию – в результате клетка перестаёт расти, перестаёт «следить за собой», а то и вовсе включает программу самоуничтожения. То есть собственно повреждения «настоящих» генов, которые идут перед теломерой, ещё не происходит, однако клетка из предосторожности решает умереть – ведь повреждение генов, которое рано или поздно случится, может вызвать злокачественное перерождение.
Но, кроме того, хромосомы, лишившиеся теломерной петли-предохранителя, склонны соединяться друг с другом оголившимися концами. Когда настаёт пора делиться, такие соединённые хромосомы просто отрываются друг от друга, чтобы разойтись по дочерним клеткам, и подобные разрывы (уже не мнимые, а самые настоящие) служат источником разнообразных мутаций, онкогенных в том числе.
Однако все эти молекулярные ужасы происходят с обычными клетками, у стволовых же всё устроено немного иначе. Как известно, у них изначально нет никакой специализации и при том они могут очень долго делиться. У стволовой клетки может включиться программа дифференциации, которая сделает из неё нейрон, или клетку кожи, или клетку печени и т. д., но приобретение определённой «профессии» неизбежно приведёт к потере «бессмертия» – теперь делиться, делиться и делиться уже не выйдет.
Стволовые клетки бывают разные, некоторые могут давать начало только определённым типам других клеток, а вот, скажем, из эмбриональных стволовых клеток может получиться всё, что угодно. Но, так или иначе, любая стволовая клетка каким-то образом обходит проблему укорочения теломер – благодаря ферменту теломеразе, которая достраивает концы хромосом, укоротившиеся после очередного деления. Своим «бессмертием» стволовые клетки обязаны именно теломеразе (которая не работает во всех остальных клетках).
Очевидно, если вдруг теломераза в стволовой клетке сломается, если её станет мало, то клетке не поздоровится: её теломеры будут быстро укорачиваться, а удлинять их будет некому. Именно такой эксперимент поставили исследователи из Института Солка: эмбриональные стволовые клетки человека, в которых уменьшали уровень фермента, в конце концов погибали. А что, если поступить наоборот: поднять уровень теломеразы в клетке выше обычного, чтобы теломеры тоже стали длиннее обычного? Выиграет ли клетка от этого? Судя по тому, что мы знаем про теломеры, так и должно произойти, однако на деле всё оказалось иначе – слишком длинные теломеры доставляют эмбриональной клетке много проблем.
В статье в Nature Structural & Molecular Biology говорится, что чрезмерно удлинившимся теломерам по ряду структурных причин трудно сформировать у себя на конце ДНК-«завиток» – ту самую предохранительную петлю, о которой шла речь выше. Конечно, на первый взгляд тут ничего сложного быть не должно, однако не стоит уподоблять ДНК швейной нитке – всё-таки это сложная двуспиральная молекула, которая принимает ту или иную пространственную структуру в зависимости от множества физико-химических факторов. В общем, сделать нужную петлю на конце у длинных теломер не выходит, несмотря даже на большой штат белков, которые обычно помогают свернуться хромосомному «хвосту». И в результате у клетки возникают те же проблемы, связанные с нестабильностью генома, что и при укорочении теломеры.
Иными словами, для того, чтобы стволовая клетка была здорова, не страдала от мутаций и спокойно делилась, теломеры в её хромосомах должны быть определённой – правильной – длины. Чтобы они не становились слишком короткими, есть теломераза, а чтобы они не становились слишком длинными, есть два специальных белка, XRCC3 и Nbs1, которые укорачивают теломеры до нужного размера.
По словам авторов работы, XRCC3 и Nbs1 работают как в природных эмбриональных клетках, так и в их искусственных аналогах – так называемых индуцированных плюрипотентных стволовых клетках. Их получают перепрограммированием зрелых, специализированных клеток (например, клеток кожи), чтобы потом вырастить из них что-нибудь другое, например, нейрон или фрагмент мышечной ткани.
С индуцированными стволовыми клетками связаны большие надежды в смысле медицинского их применения, однако, если мы хотим их использовать в клинике, то мы должны быть абсолютно уверенными, что они поведут себя так, как нужно, что они не начнут мутировать и превращаться в опухоль. Очевидно, что, оценивая качество искусственных стволовых клеток, обязательно нужно проверять, как у них работают белки, что следят за правильной длиной теломер.
Источник: НАУКА И ЖИЗНЬ

