Абсолютно чужие друг другу гены митохондрий и гены ядра, встретившись в одной клетке, вызывают в ней небольшой стресс, от которого, впрочем, организму одна только польза.
Почти все человеческие гены, а их числом более 20 тысяч, записаны в ДНК, находящейся в клеточном ядре. И совсем немного, всего 37, хранятся не в ядре, а в митохондриях – органеллах клетки, плавающих в цитоплазме. Задача митохондрий – обеспечивать организм энергией, добывая её из «питательных» молекул с помощью целой системы биохимических реакций.
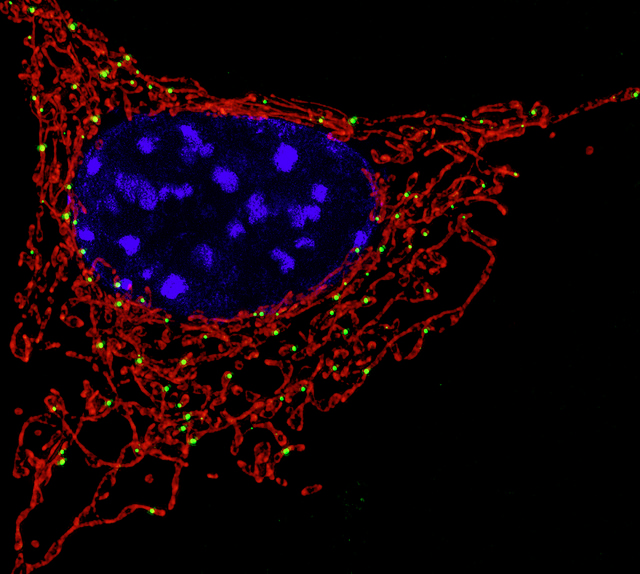
Клетка с ядром (окрашено синим) и митохондриями (окрашены красным)
Эти реакции выполняют белки, часть которых закодирована как раз в митохондриальном геноме. (Кстати говоря, в своё время именно наличие у митохондрий собственной ДНК легло в основу гипотезы, что они в прошлом были самостоятельными одноклеточными организмами, которые сумели найти общий язык с теми, кто их ел, и стали их симбионтами.)
И ядерная ДНК, и митохондриальная подвержены мутациям, причём ДНК митохондрий считается более изменчивой. Дефекты в ней могут приводить к специфическим синдромам, которые так и называют – митохондриальными заболеваниями. С другой стороны, учитывая сверхважную роль митохондрий в нашей жизни, накапливающиеся в них мутации могут нарушать обмен веществ и тем самым вносить свой вклад в «обычные», немитохондриальные болезни. Однако в целом считается, что основная масса генетических изменений в митохондриях никак себя не проявляет. То есть отличий в последовательности ДНК в митохондриях разных клеток (и даже в митохондриях внутри одной клетки) может быть масса, но никаких физиологических последствий от них не происходит.
Со временем биологи стали осознавать, что всё не совсем так, то есть физиологические эффекты, возникающие из-за митохондриальных мутаций, пусть и невелики, но есть. И вот исследователи из испанского Национального центра сердца решили в целом оценить, насколько особенности генома митохондрий влияют на организм. Как известно, эти органеллы наследуются только по материнской линии: в клетках взрослого организма и у нас, и у мышей есть только те митохондрии, предки которых находились в яйцеклетке. Что до ядерной ДНК, то мы все хорошо помним, что половину хромосом мы получаем от матери, половину – от отца. Как проверить влияние митохондриального генома на жизнь индивидуума? Нужно сделать так, чтобы митохондриальный и ядерный геномы были целиком от разных предков.
Чтобы добиться такого результата, Хозе Антонио Энрикес с коллегами скрещивали самок мышей одной линии с самцами другой линии, получившееся потомство снова скрещивали с самцами той же линии, и т. д. Постепенно гены самцовой линии вытесняли у гибридов гены пра-пра-пра-бабушек, и через 20 поколений такого скрещивания на руках у исследователей были мыши, у которых ДНК в ядрах клеток была только пра-пра-пра-дедушкина. Но митохондрии, как мы только что сказали, наследуются по материнской линии, то есть митохондриальный геном у получившихся животных был пра-пра-пра-бабушкин. Два генома в клетке были чужими друг другу, так как у генов митохондрий в ядре не было никаких «знакомых» от самок-прародительниц.
Сами мыши от такой ситуации только выиграли. В статье в Nature говорится, что животные с разнородными геномами в среднем жили дольше (хотя максимальный срок жизни остался примерно таким же, как у обычных мышей), у них реже появлялись злокачественные опухоли, уровень холестерина в крови оставался стабильным, яичники с возрастом лучше сохранялись – в общем, животные чувствовали себя лучше и реже болели в старости. Но самый главный сюрприз был в том, что уровень кислородных радикалов у них – по крайней мере, в молодости – оказывался выше, чем у обычных мышей.
Кислородными радикалами называют довольно агрессивную разновидность молекул-окислителей, способных портить ДНК и белки. Основным их источником считаются митохондрии, у которых такие радикалы возникают в качестве неизбежного побочного продукта энергетических реакций. Довольно долго считалось, да и сейчас многие думают так же, что старение и возрастные болезни возникают из-за вышедших из-под контроля кислородных радикалов, когда клетка уже не может сдерживать окислительный стресс. Однако новые данные такой точке зрения, как видим, несколько противоречат. Сами авторы работы полагают, что тут имеет место гормезис – так называют физиологическое явление, когда умеренное действие стрессорных факторов идёт организму на пользу, стимулируя некие внутренние резервы. В данном случае получается, что немного окислительного стресса на каком-то этапе жизни – это даже хорошо.
Что до молекулярных механизмов, то тут пока с полной уверенностью говорить ни о чём нельзя, но можно предположить, что определённую роль играет нестыковка между разными частями митохондриальных белковых комплексов. Митохондрии, как мы говорили выше, буквально напичканы разными ферментами, объединёнными в сложные надмолекулярные структуры, и, хотя часть ферментов кодируется генами митохондрий, другая кодируется генами ядра. Вполне возможно, что когда встречаются белки из совсем неродственных друг другу митохондриального и ядерного геномов, между ними возникают какие-то трения, которые выливаются в небольшой полезный стресс. Поэтому мы и взяли на себя смелость сказать в заголовке про «геномные разногласия», однако, повторим, что за разногласия и как именно они работают, предстоит выяснить в дальнейших исследованиях.
Источник: НАУКА И ЖИЗНЬ

