Иммунные клетки синтезируют вещество, которое не позволяет самим клеткам запустить воспаление.
Когда в организм попадает что-то чужеродное и потенциально опасное, то первыми его встречают макрофаги – клетки иммунной системы, которые в буквальном смысле этого слова поедают непрошеных гостей. Пока организму ничего не угрожает, макрофаги пребывают в неактивном состоянии – в таком виде их называют моноцитами, или макрофагами М0. Но стоит им почуять неладное, как они превращаются в клетки типа М1, стимулирующие воспаление, и клетки типа М2, обладающие уже противовоспалительными свойствами. Прибыв к месту вторжения, макрофаги развивают бурную деятельность по уничтожению патогенов, и воспалительная реакция есть необходимая составляющая истребления чужаков-вредителей.
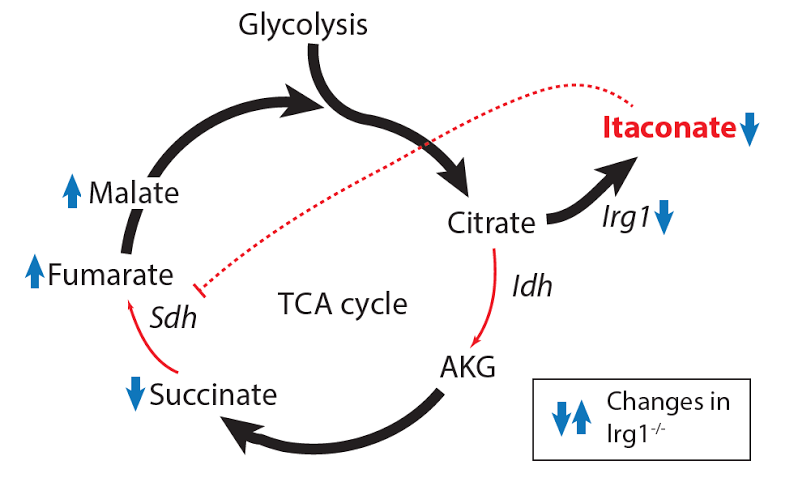
Схема действия итаконата на цикл трикарбоновых кислот. Irg – ген, отвечающий за синтез итаконата.
Изучив процесс перехода макрофагов из неактивного состояния в воспалительное, исследователи из Университета Вашингтона в Сент-Луисе, Университета информационных технологий, механики и оптики (ИТМО), Университета Макгилла и Института иммунобиологии и эпигенетики Общества Макса Планка обнаружили, что воспалительную активность в макрофагах может подавлять вещество под названием итаконат, или отрицательно заряжённый остаток итаконовой кислоты.
Итаконат синтезируют сами макрофаги, когда переходят из состояния М0 в М1. Если его станет слишком много, активация макрофагов замедлится. «Итаконат выставляет определенную планку, сдерживая образование М1-макрофагов, – рассказывает Алексей Сергушичев, один из авторов статьи и аспирант Университета ИТМО. – Без этого вещества воспалительный процесс увеличивался бы больше, чем требуется».
Почему итаконат снижает активность иммунных клеток, стало понятно из особенностей их цикла Кребса, или цикла трикарбоновых кислот. Так называют цепочку универсальных биохимических реакций, встроенных в большую машину энергического обмена веществ: реакции цикла необходимы для получения энергии и заодно для синтеза некоторых важных служебных молекул. Естественно, цикл Кребса должен чувствовать потребности клетки, поэтому один из его ферментов, называемый сукцинатдегидрогеназой (Sdh), постоянно «общается» с сигнальными путями, которые по молекулярным цепочкам передают информацию о том, что происходит внутри и снаружи клетки.
Как пишут авторы работы в Cell Metabolism, итаконат подавляет фермент Sdh, в результате чего макрофаги начинают меньше поглощать кислорода и меньше выделяют воспалительных сигнальных молекул. «Интересно, что итаконат выступает и как антиоксидант, и как противовоспалительное средство, – отмечает Вики Лампропулу, ведущий автор статьи, сотрудник лаборатории Максима Артемова в Университете Вашингтона в Сент-Луисе. – В то же время, итаконат безопасен, поскольку производится самим организмом. Это делает его крайне привлекательным для использования в терапии многих патологий, возникающих вследствие чрезмерного воспаления или окислительного воздействия, например, ишемической болезни сердца, печени и почек, метаболических нарушений и, возможно, аутоиммунных заболеваний».
«В перспективе с помощью итаконата можно будет искусственно контролировать переход макрофагов из неактивного в воспалительное состояние, а значит, сдерживать интенсивность воспаления. Воздействие итаконата на макрофаги – достаточно тонкий механизм, способный обеспечить высокую селективность регуляции работы иммунной системы», – считает Алексей Сергушичев. Эксперименты показали, что итаконат эффективен при инфаркте миокарда у мышей, действуя по тому же механизму блокировки фермента Sdh. Однако, как обычно, здесь потребуется ещё ряд экспериментов, прежде чем итаконат можно будет использовать в клинической практике.
Источник: НАУКА И ЖИЗНЬ

