ДНК большинства организмов состоит из 4 стандартных оснований и небольшого набора модифицированных оснований, которые получаются из базовых 4-х оснований при воздействии на них ферментов, после репликации ДНК. Одно такое модифицированное основание, N6mA, превалирует в прокариотах (бактерии, археи), однако оставалось неясным содержится ли оно в млекопитающих. В статье в Nature, Ву с соавт. объявили о существовании N6mA в стволовых клетках мыши. Данное волнующее открытие сопровождается и открытием фермента, который удаляет метиловые группы у N6mA, а также открытием, что некоторые регуляторные последовательности ДНК имеют повышенное содержание такой модификации, все это предлагает возможные «ключи» к возможной функции N6mA в геноме млекопитающих.
Самое распространенное модифицированное основание в геноме млекопитающих – 5-метилцитозин (5mC), который регулирует экспрессию генов и ретротранспозонов, которые, в свою очередь, через обратную транскрипцию производят промежуточную РНК, передвигающийся по геному и разрушая генную регуляцию. Ферменты, Ten-eleven Translocation (TETs), могут окислять 5mC и формировать 5-гидроксиметилцитозин и другие производные. В геномах прокариот, N-метилцитозин и N6mA также распространены и считается, что помимо других функций эти основания модифицируют репликацию и репарацию ДНК. Более того, N6mA был обнаружен в некоторых одноклеточных эукариотических организмах (содержащих ядро).
Долго считалось, что N6mA отсутствовал в ДНК большинства многоклеточных организмов. Однако, это было неточно в связи с отсутствием существенного количества чувствительных методов, из-за чего глубокий анализ редких модифицированных оснований был невозможен. В 2015, в ходе трех исследований, было охарактеризовано эукариотический N6mA в деталях – в зеленой водоросле (Chlamydomonas reinhardtii), в нематоде (Caenorhabditis elegans) и в плодовой мушке (Drosophila melanogaster). В данных сообщениях было указано, что количество этой модификации различается между эукариотическими видами, и нашли подтверждение, что во всех трех организмах N6mA ассоциируется с активной транскрипцией.
Ву с соавт. искали N6mA в эмбриональных стволовых клетках мыши. Используя масс спектрометрию, они обнаружили, что N6mA представляло 6-7 оснований на миллион аденинов в геноме. В участках генома, ассоциированных с редким гистоновым протеином H2AX (свидетельствует о присутствии двунитевого разрыва и инициирует репарацию), количество N6mA было увеличено примерно в 4 раза, хотя причины этого до сих пор неясны.
Далее, авторы обратили внимание на фрагменты ДНК, связанные с этим атипичным гистоновым протеином, который часто ассоциирован с геномными регионами, принимающими участие в регуляции и развитии клетки. Анализ данных конкретных последовательностей дал исследователям возможность использовать исключительную высокотехнологичную методику SMRT (single molecule real time) секвенирование, с помощью которой определяют разную кинетику, используемой полимеразой для репликации модифицированных оснований по сравнению со стандартными основаниями. SMRT секвенирование было использовано для определения N6mA в некоторых прокариотах, Ву с соавт. использовали технологию консенснусных ДНК последовательностей в которых N6mA встречается в клетках мыши.
Ферменты-деметилазы удаляют метиловые группы из ДНК, РНК или протеинов. Несколько N6mA деметилаз из семейства протеинов ALKB удаляют метиловые группы из N6mA в РНК – например, для того, чтоб регулировать mRNA. В млекопитающих, данное семейство протеинов состоит из 9 членов. Ву с соавт. обнаружили что делеция одного из протеинов, ALKBH1, в стволовых клетках мыши привело к высокому аккумулированию N6mA в геноме, и что ALKBH1 может удалять метиловые группы в N6mA в ДНК in vitro.
Возможно также, что и другие ALKBH протеины также обладают активностью ДНК N6mA деметилаз, потому что ALKBH4, 6 и 7 не имеют конкретно определённых субстратов. Интересно, что ALKBH1 более эффективно работал на одноцепочной ДНК in vitro, что ведет к вопросу, предпочитает ли данный энзим функционировать в течение транскрипции или ДНК репликации in vivo, когда ДНК является одноцепочной. Необходимо вспомнить, что N6mA деметилаза C. elegans, NMAD-1, которая больше всего схожа с ALKBH4, чем любой другой протеин млекопитающих, работает на двухцепочной ДНК. Таким образом, ALKBH4 должно быть тоже является N6mA деметилазой млекопитающих, возможно функционирующей на другой стадии клеточного цикла чем ALKBH1.
Ву с соавт. осуществили делецию ALKBH1 гена в стволовых клетках и обнаружили что N6mA аккумулировался в Х хромосоме этих клеток. Данное скопление произошло в регуляторных регионах эволюционно молодых последовательностях LINE-1 ретротранспозонов (тех, которые передвинулись относительно недавно), в связи с чем можно предположить, что N6mA может помочь контролировать данные «геномные паразиты». Действительно, присутствие N6mA коррелировало не только с ингибированной экспрессией LINE-1 элементов, но и их фланкирующих генов (Рис. 1). Данное открытие ведет к предположению, что N6mA играет роль в инактивации Х хромосом млекопитающих – феномену, компенсирующему тот факт, что женские особи имеют 2 Х хромосомы в отличие от мужских.
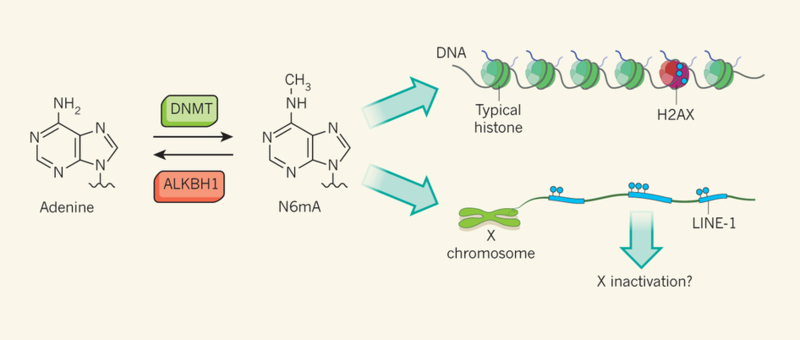
Рисунок 1. Метилирование в N6 позиции аденина ДНК метилтрансферазой ведет к образованию модифицированного основания - N6mA. Ву с соавт. сообщают, что в млекопитающих деметилаза ALKBH1 удаляет метиловый радикал. Авторы обнаружили, что N6mA можно обнаружить в повышенном количестве в регионах, ассоциированных с редким гистоновым белком H2AX (N6mA обозначен голубыми кружками) а также в LINE-1 элементах на Х хромосоме. На Х хромосоме количество N6mA коррелировало со сниженной экспрессией LINE-1 элементов и фланкирующих (Находящихся по соседству) генов, что указывает на то, что данное модифицированное основание может играть роль в контроле LINE-1 и инактивации Х хромосомы.
Роль генного сайленсера N6mA в эмбриональных стволовых клетках мышей не соответствует его предполагаемой роли в активации генной транскрипции в простейших эукариотах. Недавно было также показано наличие N6mA в ДНК почек лягушки и мыши, и выявлено, что данной модифицированное основание встречалось относительно редко в последовательностях, кодирующих белки. Однако, эффект данного недостатка N6mA на транскрипцию необходимо еще изучить.
Выявленное Ву с соавт. наличие N6mA в геноме млекопитающих подняло много вопросов. Например, почему метиллирование N6-аденина происходит столь по-разному и в разных ДНК последовательностях в разных эукариотических организмах? Распространена ли данная модификация по-разному в разных тканях и на разных стадиях эмбрионального развития? Понимание данной вариабельности может указать на какую-то общую роль N6mA в эукариотах.
Ферменты, которые добавляют метиловые группы к аденину в ДНК млекопитающих, необходимо еще определить, а также протеины-«читатели», которые находят N6mA в геноме. Среди кандидатов на роль протеинов-читателей, которые могут «читать» N6mA код могут быть несколько протеинов млекопитающих, домены которых взаимодействуют с N6mA в ДНК.
ALKB протеины на данный момент являются единственными известными N6mA деметилазами млекопитающих. В плодовых мушках, родственник TET 5mC оксидазы играет роль N6mA деметилазы. Однако, существование 5mC в этих организмах является все еще под сомнением, и протеин плодовых мушек структурно отличается от ALKB протеинов. Таким образом, остается неясным, является ли TET 5mC оксидаза аналогом N6mA деметилазы млекопитающих.
Уровни N6mA в многоклеточных организмах являются исключительно низкими. Так что для того, чтобы начать отвечать на эти вопросы, необходимо подождать на дальнейшее развитие технологий, что позволит изучать эти редкие модификации. Такая возможность конечно же поднимет данную сферу исследований на новый уровень.
Источник: NATURE

