Забытые из-за синдрома Альцгеймера воспоминания можно вернуть, если активировать клетки, отвечающие за доступ к ним.
Главным и одним и первых симптомов болезни Альцгеймера считается утрата памяти – человек сначала помнит недавнее прошлое, а потом дело доходит и до старых воспоминаний. Однако, как уверяют исследователи из лаборатории Судзуми Тонегавы в Массачусетском технологическом институте, память при синдроме Альцгеймера на самом деле сохраняется, просто исчезает доступ к ней. Если перевести это на компьютерно-цифровой язык, можно сказать, что из памяти исчезает путь к файлу, но сам файл всё-таки есть.
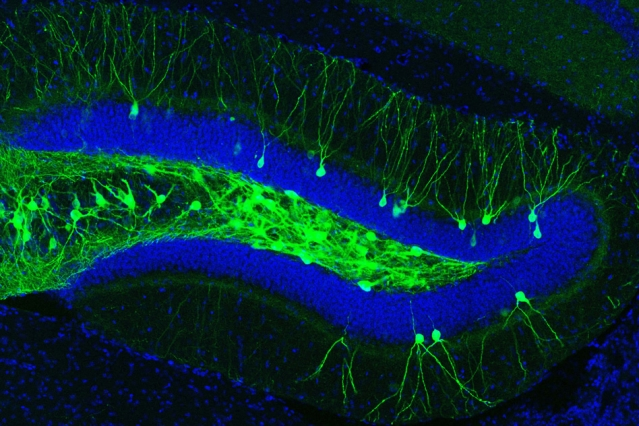
Гиппокамп мыши и его энграммные клетки (окрашены зелёным), отвечающие за страшные воспоминания.
Профессор Тонегава – один из известнейших людей в современной нейробиологии, хотя раньше он занимался молекулярной генетикой антител, и даже получил в 1987 году Нобелевскую премию за открытие генетического принципа разнообразия антител. Однако впоследствии он переключился на исследования клеточных механизмов памяти, добившись здесь выдающихся результатов. Тонегаве и его команде удалось определить в гиппокампе (который служит одним из главных центров памяти в мозге) нейроны, отвечающие за специфические воспоминания – манипулируя активностью таких нервных клеток, нейробиологам удалось превратить плохие воспоминания в хорошие, подавить депрессию, активировав положительные воспоминания, и даже заставить мозг вспомнить то, что он забыл.
Одним из важнейших результатов группы Тонегавы стало то, что им удалось подтвердить существование в гиппокампе так называемых энграммных клеток. Под энграммой понимают след, оставленный раздражителем; если говорить о нейронах, то повторяющийся сигнал – звук, запах, некая обстановка и т. д. – должны провоцировать в них некие физические и биохимические изменения. Если стимул потом повторится, то «след» активируется, и клетки, в которых он есть, вызовут из памяти всё воспоминание целиком.
Иными словами, энграммные («ключевые») нейроны отвечают за доступ к записанной информации, а чтобы сами они заработали, на них должен подействовать ключевой сигнал. Но, кроме того, такие клетки должны уметь как-то сохранять следы от раздражителей. На практике это означает, что между энграммными клетками должны усиливаться межклеточные синапсы: чем прочнее они будут, тем надёжнее между ними будет проходить сигнал, тем крепче нейроны запомнят некий стимул. То есть, за хранение и за активацию памяти отвечают разные структуры – группы энграммных клеток опекают другие нервные цепочки, хранящие блоки информации, и нейроны акивации можно в некотором смысле сравнить с библиотекарями, выдающими книги по запросу.
В экспериментах по восстановлению памяти, о которых мы писали летом прошлого года, речь шла как раз о том, что исчезнувшие воспоминания на самом деле никуда не исчезли, просто клетки-«библиотекари», которые отвечают за их хранилище, утратили активность – грубо говоря, заснули. И чтобы восстановить воспоминания, доступ к которым оказывается заблокирован, например, при ретроградной амнезии (так называют нарушение памяти о том, что произошло до какого-то критического момента – например, до травмы мозга или до сильного стресса), нужно просто разбудить нужные энграммные клетки.
В опытах на мышах ретроградную амнезию животным устраивали с помощью специального антибиотика, ослабляющего синапсы – межнейронные соединения оказывались непрочными, и клеточная цепочка функционировала плохо: информация о том, что происходило перед введением препарата, у мышей в голове не задерживалась.
В новой статье в Nature исследователи сообщают, что точно так же можно вернуть память и в случае болезни Альцгеймера. В ней, по сути, нет ничего сугубо человеческого, ту же самую патологию, связанную с аномальными белковыми накоплениями, можно спровоцировать и у животных, и для новых опытов использовали мышей, генетически предрасположенных к этому нейродегенеративному заболеванию.
И тех, и других запускали в клетку, в которой мышей через пол слегка били током. Спустя несколько часов животные помнили, что от электроклетки ничего хорошего ждать не следует, и, когда их снова туда сажали, они замирали на месте, демонстрируя обычный для грызунов ответ на стресс. Однако спустя несколько дней память об электрическом шоке сохранялась только у нормальных животных. Те же, у которых в нейронах шли альцгеймерические процессы, о пережитом стрессе забывали – вид клетки никаких неприятных воспоминаний у них не включал.
Но если энграммные клетки, отвечающие за именно этот стрессовый опыт, активировали искусственно, оптогенетическим способом, то у мышей с «альцгеймером» память просыпалась, и они, попав в электрошоковую клетку, замирали на месте, как и обычные мыши. Также удалось показать, что у энграммных клеток мышей, предрасположенных к нейродегенеративным процессам, образуется меньше дендритных шипиков – так называют выступы на клеточной мембране в тех местах, где нейрон может сформировать синапс, межклеточное соединение с другим нейроном, и включиться в нервную цепочку.
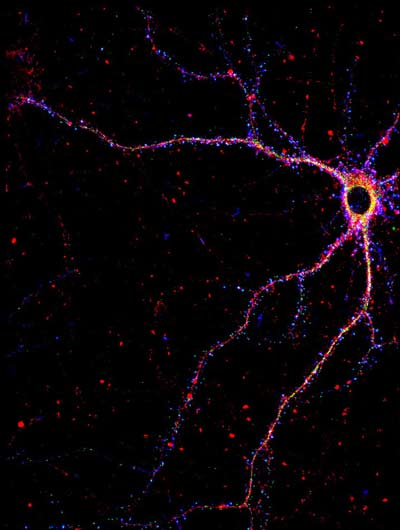
Дендритные шипики (синие точки) на нейроне
Клетки-«библиотекари» не могли установить достаточно прочную связь с нейронами энторинальной коры, которые давали бы им сенсорные «ключи», относящиеся к конкретному воспоминанию. Поэтому внешний вид страшной клетки не производил впечатления на больных мышей, хотя сам неприятный опыт пребывания в ней никуда из их памяти не делся. Если же постоянный контакт между энторинальной корой и энграммными клетками удавалось установить – опять же без помощи оптогенетических методов – то память к животным возвращалась окончательно, и даже спустя неделю они помнили, когда и где нужно бояться, хотя потом уже никаких стимуляторов памяти к ним не применяли.
Отсюда следует несколько важных выводов. Во-первых, снова удалось подтвердить теорию, что ухудшение памяти может быть связано не столько с исчезновением собственно информации, сколько с её недоступностью.
Во-вторых, энграммные клетки, которые как раз и помогают найти нужный «файл», контролируют не только условно свежие воспоминания, которые только-только сформировались, но и довольно старые.
В-третьих, при болезни Альцгеймера – во всяком случае, на её начальных этапах – возникает та же «проблема доступа», так что память больным, очевидно, можно было бы возвращать, будь у нас инструмент для активации пресловутых энграммных клеток. Однако оптогенетические методы, которые позволяют очень точно включать и выключать нейроны, предполагают генетическую модификацию клеток (коротко о принципах оптогенетики можно почитать здесь), и к человеку их применить вряд ли возможно.
Остаётся только надеяться, что нейробиологам удастся разработать какой-нибудь клинический метод, позволяющий активировать человеческие нейроны без сложных генетических манипуляций.
Источник: НАУКА И ЖИЗНЬ

