Параллельный анализ молекул РНК, которые синтезируются сальмонеллами и клетками человека во время инфекции, показал, как бактериальная малая РНК изменяет транскрипционные профили не только клеток сальмонеллы, но и клеток человека.
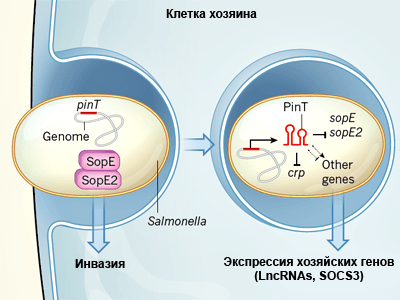
Малая некодирующая РНК сальмонелл влияет не только на экспрессию бактериальных генов, но и на экспрессию генов клетки хозяйского организма.
Что происходит, когда бактерия сталкивается с клетками хозяйского организма? А когда проникает внутрь? За счет чего бактерия выживает в новой для нее среде? Как клетки хозяина защищаются от патогенов? Чтобы ответить на все эти вопросы, необходимо понять, как изменяется транскрипция генов во взаимодействующих клетках. За последние годы было разработано множество подходов: от анализа экспрессии генов in vivo до секвенирования полного транскриптома бактерий и хозяйских клеток. Однако все они фокусировались на матричных РНК одного из объектов (бактерии или клетки-хозяина), но не обоих сразу.
Полногеномное секвенирование РНК (RNA-seq) — это очень чувствительный метод глобального анализа экспрессии генов, использующийся в инфекционной биологии. Однако в изучении внутриклеточных бактериальных инфекций есть свои трудности: в процессе участвуют два разных организма с совершенно разными наборами РНК. Обычно эти организмы физически разделяют, а затем секвенируют транскриптомы каждого из них. Причем ограничиваются лишь матричными РНК, поскольку именно они дают информацию о производимых в клетке белках, и пренебрегают РНК, считывающимися с некодирующих регионов.
RNA-seq
RNA-seq — это метод высокопроизводительного секвенирования (или секвенирования нового поколения, NGS) полного транскриптома, позволяющий определять последовательность РНК с высокой точностью (до 99,9%) и производить параллельно до 500 000 процессов секвенирования.
Определение последовательности РНК производится либо секвенированием кДНК, либо прямым секвенированием фрагментов РНК. Сейчас для этого используют несколько технологических платформ:
Illumina (метод «секвенирования путем синтеза», в котором применяют нуклеотиды с флуоресцентными метками разных цветов);
Roche 454 Life Science (метод «секвенирования путем синтеза» — пиросеквенирование, при котором к матрице добавляют последовательно монорастворы каждого из четырех нуклеотидов и регистрируют высвобождающиеся пирофосфаты после присоединения комплементарного нуклеотида к растущей цепи);
Ion Torrent (метод «секвенирования путем синтеза», при котором к матрице добавляют последовательно монорастворы каждого из четырех нуклеотидов и ионным датчиком фиксируют изменения pH при выделении ионов водорода во время полимеризации ДНК);
Applied Biosystems SOLiD (метод основан на секвенировании коротких фрагментов кДНК путем последовательного лигирования комплементарных матрице зондов с флуоресцентными метками);
Helicos Biosciences tSMS (технология прямого секвенирования — без предварительной амплификации — единичных молекул РНК с использованием флуоресцентных меток);
Pacific Biosciences SMRT (основан на наблюдении в реальном времени за работой единичной молекулы полимеразы в присутствии меченных флуоресцентными метками нуклеотидов).
Бактерии синтезируют множество некодирующих малых РНК (small RNA, sRNA), роль которых в патогенезе всё еще остается малопонятной — ведь такие РНК не находят своего отражения в фенотипе вирулентности. Эти малые РНК оказывают посттранскрипционное влияние на экспрессию генов у многих организмов. Исключением не является и Salmonella enterica серовар Typhimurium, у которой транскрибируются сотни малых регуляторных РНК. Многие из них активны лишь в условиях стресса или при инфицировании. Однако делеция генов таких РНК приводит к незначительному изменению фенотипа — возможно, потому, что малые РНК отвечают за точную настройку процессов экспрессии, а не за сами процессы. Чтобы узнать функции малых РНК во время инфекции, необходимы высокочувствительные методы исследования.
Salmonella enterica subsp. enterica, серовар Typhimurium
Сальмонеллы — грамотрицательные палочковидные бактерии. Salmonella enterica — один из двух видов сальмонелл, насчитывающий 6 подвидов и более 2500 сероваров. Эти организмы — факультативные анаэробы, вызывающие преимущественно желудочно-кишечные заболевания: сальмонеллёз, брюшной тиф, паратифы.
При попадании в организм Salmonella Typhimurium развивается сальмонеллёз (брюшной тиф вызывает Salmonella Typhi). Этот серовар — не единственный возбудитель сальмонеллёза, но в большинстве внутрибольничных (нозокомиальных) вариантов болезни повинен именно он. Вне стационаров обычно заражаются при поедании сырых/недоваренных яиц, реже — молочных и мясных продуктов, опять же, не прошедших должную термическую обработку. А можно просто не помыть руки или кухонный инвентарь после работ со всеми этими продуктами — и неделя лихорадки и пробежек до санузла гарантирована.
Оказавшись в кишечнике, сальмонеллы стремятся попасть в собственную пластинку слизистой оболочки. Потому кишечный эпителий для них — барьер, который бактерии должны миновать. Для этого сальмонеллы провоцируют перестройку цитоскелета клеток эпителия, приводящую к образованию складок в их мембране. Процесс контролируется двухкомпонентной сигнальной системой PhoP/PhoQ, регулирующей экспрессию генов вирулентности, и приводит к заключению бактерий в эндосомы, в которых они переносятся через эпителиальные клетки в собственную пластинку слизистой. Стоит отметить, что сальмонеллы «болтливы» и решают сложные задачи коллективно: некоторые гены вирулентности находятся у них под контролем чувства кворума. Во время инвазии сальмонеллы транскрибируют гены из региона, называемого островом патогенности Salmonella 1 (Salmonella pathogenicity island 1, SPI-1). Когда бактерии оказываются внутри клетки, активность этого острова падает и начинается транскрипция генов из региона SPI-2, которые отвечают за внутриклеточную выживаемость.
Typhimurium — вообще очень хитрая бактерия, нашпигованная крайне полезными мобильными генетическими элементами разного происхождения — как профагами, кодирующими ферменты конверсии поверхностных антигенов сальмонеллы и факторы вирулентности, так и геномными островами, предоставляющими бактерии-хозяину не только факторы патогенности, но и устойчивость к антибиотикам.
Клетки S. enterica sv. Typhimurium.
Группа ученых из нескольких институтов Германии предложила новый метод изучения РНК клеток человека и их внутренних паразитов — бактерий. Исследователи решили провести одновременный анализ РНК патогена и хозяйской клетки — двойное секвенирование РНК (dual RNA-seq). Причем не стали ограничиваться лишь матричными РНК, а изучили и малые регуляторные РНК бактерий.
Эксперимент с человеческими клетками, инфицированными сальмонеллой
А. Вестерманн и коллеги использовали Salmonella Typhimurium и клетки линии HeLa, в которых бактерия может длительно размножаться. Идентификацию клеток HeLa с сальмонеллами внутри проводили по зеленому флуоресцентному белку (GFP), синтезируемому бактериями. Методом флуоресцентно-активированного отбора (Fluorescence Activated Cell Sorting, FACS) изучали клетки на 4-м часу после инфицирования (в среднем там находили 10 бактерий) и по прошествии 24 часов (75 бактерий). В качестве контроля использовали неинфицированные клетки (рис. 1). Из образцов выделяли тотальную РНК и на аппаратуре Illumina проводили двойное секвенирование кодирующих и некодирующих молекул.
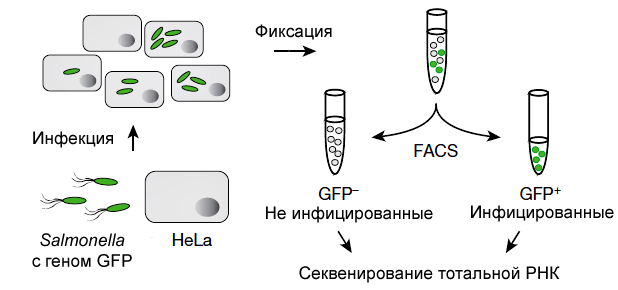
Рисунок 1. Схема двойного секвенирования РНК (dual RNA-seq).
Малые РНК внутриклеточных сальмонелл
Чтобы повысить информативность двойного секвенирования, исследователи проанализировали малые РНК бактерий в образцах, взятых не только через 4 и 24 часа, но и через 2, 8 и 16 часов после инфицирования. Таким образом были идентифицированы 145 известных и 189 новых малых РНК сальмонеллы. Синтез некоторых из них возрастал более чем в 10 раз уже на второй час после инвазии.
Функция малых РНК состоит в том, что, соединяясь с целевыми матричными РНК, они модулируют их стабильность и экспрессию. Исследователи обнаружили наиболее активную 80-нуклеотидную малую РНК, чья транскрипция возрастала более чем в 100 раз во время инфекции, и назвали ее PinT. Ген этой РНК приобретен сальмонеллами горизонтально и активируется бактериальной сигнальной системой PhoP/PhoQ.
Анализ показал, что PinT снижает уровень транскрипции генов sopE и sopE2 из региона SPI-1 — генов эффекторных белков, которые участвуют в процессе инвазии (рис. 2). Также эта малая РНК регулирует экспрессию РНК белка CRP (рецептора цАМФ), который участвует в активации генов внутриклеточной выживаемости бактерий. Блокируя РНК CRP, PinT модулирует активность второго острова патогенности — SPI-2.
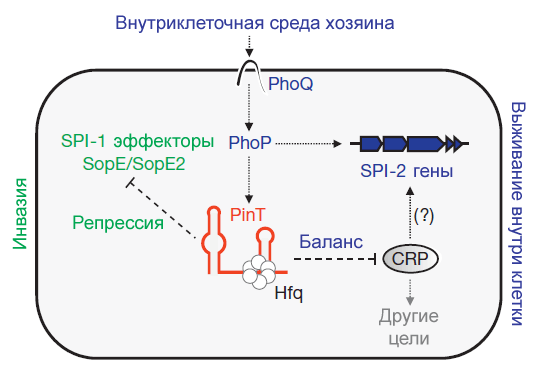
Рисунок 2. Схема регуляции экспрессии генов вирулентности малой РНК PinT. Стрелками с острыми концами показано положительное влияние, стрелками с тупыми концами — негативное влияние.
Полученная информация позволяет утверждать, что PinT регулирует переход сальмонеллы из фазы вирулентности в фазу внутриклеточного выживания, оказывая влияние на гены островов SPI-1 и SPI-2.
Влияние PinT на реакцию хозяйской клетки
С помощью одновременного секвенирования РНК бактерии и клетки-хозяина удалось выяснить, как малые РНК сальмонеллы влияют на процессы внутри клеток HeLa. В эксперименте использовали Salmonella Typhimurium дикого типа и с делецией pinT.
Оказалось, что в отсутствие PinT наблюдается повышенная активность регуляторного белка SOCS3, который ингибирует фосфорилирование транскрипционного фактора STAT3, запрещая его активацию и транспортировку в ядро клетки (рис. 3). SOCS3 — белок воспалительного сигнального пути, играющий важную роль в течении инфекции: небольшое воспаление понижает способность сальмонеллы конкурировать с кишечной микробиотой, а слишком сильное — приводит к уничтожению бактериальных клеток хозяином. Роль PinT в данном случае — поддерживать оптимальное для развития бактерий количество SOCS3 в человеческой клетке.
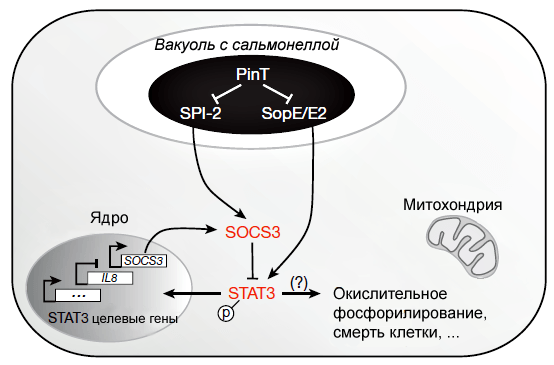
Рисунок 3. Схема влияния PinT-зависимых бактериальных эффекторов на биохимические процессы в хозяйской клетке. Стрелками с острыми концами показано положительное влияние, стрелками с тупыми концами — негативное влияние.
Кроме того, делеция PinT повышала выработку интерлейкина 8 (IL-8) — провоспалительного хемокина.
То есть посредством влияния на эффекторные белки SopE и SopE2 PinT регулирует синтез интерлейкина 8, а контролируя некоторые гены острова SPI-2, оказывает влияние на активность SOCS3.
Вместе с тем метод dual RNA-seq показал связанный с инфекцией синтез длинной некодирующей РНК (long noncoding RNAs, lncRNAs). Определенные днРНК очень быстро отвечают на PinT-зависимые изменения в клетке, а потому могут использоваться при диагностике сальмонеллёза как чувствительные маркеры ранних стадий инфекции.
Сальмонелла также устойчиво влияет на митохондрии клетки-хозяина: бактериальный штамм без PinT вызывал гиперактивацию синтеза РНК митохондрий, включая гены пути окислительного фосфорилирования, а также изменял внутриклеточную локализацию самих митохондрий.
В дальнейшем метод высокопроизводительного двойного секвенирования РНК поможет понять многие скрытые взаимосвязанные процессы в болезнетворных бактериях и хозяйских клетках при инфицировании не только сальмонеллой, но и другими микроорганизмами.
Источник: БИОМОЛЕКУЛА

