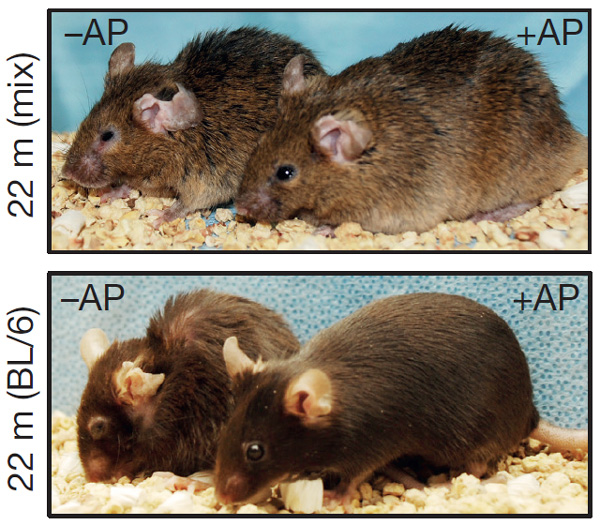
Рис. 1. Мыши двух генетически модифицированных линий, у которых можно уничтожать стареющие клетки, если давать им лекарство AP20187. +AP — 22-месячные мыши, которым давали лекарство в возрасте от 12 до 18 месяцев, –AP — мыши того же возраста, которым не давали лекарства.
Американские ученые получили две линии мышей, у которых можно уничтожать стареющие клетки. Благодаря такой терапии удалось отсрочить у экспериментальных животных развитие старческих болезней, оздоровить их, а также увеличить их среднюю продолжительность жизни на 17–35%.
Клеточное старение — важнейший биологический процесс, без понимания которого нет надежд на существенное увеличение продолжительности здоровой жизни. Старение всего организма определяется, в частности, тем, с какой скоростью удается избавляться от вышедших из строя клеток. Высокий процент стареющих клеток ведет разными путями к развитию старческих болезней. К примеру, факторы воспаления, которые выделяет вставшая на путь старения клетка, нужны, чтобы привлечь к ней внимание иммунной системы. Но если старых клеток становится слишком много, провоспалительные факторы нарабатываются в избытке, приводя к развитию ревматоидного артрита, атеросклероза и миопатий.
Характерные признаки клеточного старения — это постепенное прекращение деления клеток (конечные участки хромосом, теломеры; сокращаются при каждом делении), секретирование веществ, стимулирующих воспаление; перевод хроматина в более компактную форму. Эти признаки должны приобретать «подозрительные» клетки — например, клетки с серьезными повреждениями ДНК (из-за чего резко возрастает риск злокачественного перерождения). Клетки, в которых произошли изменения, опасные для всего организма, уничтожаются и, по возможности, заменяются новыми, возникшими в результате деления стволовых клеток.
Поскольку большая часть клеток тела животного постоянно обновляется, даже организм давно живущего на свете существа содержит лишь небольшую долю клеток, проявляющих признаки старения (хотя с возрастом доля таких клеток возрастает). Так, было показано, что у молодых мышей доля клеток с признаками старения составляет 8%, а у очень старых — 17%.
Всё это наводит на мысль о том, что организму надо помогать избавляться от клеток, в которых начался процесс старения. Претворить эту идею в жизнь в 2011 году попробовали американские ученые из Медицинского колледжа при Клинике Майо (Рочестер, США). Им удалось замедлить появления признаков болезни у мышей с прогерией — преждевременным старением организма. Для этого ученые получили особую линию мышей, у которых можно было запустить самоуничтожение клеток организма, нарабатывающих в значительных количествах белок p16Ink4a. Этот белок, помогающий блокировать деления клеток, относится к самым распространенным маркерам клеточного старения. Идея ученых подтвердилась: усиленное уничтожение стареющих клеток помогло мышам с прогерией стариться не так быстро.
Данные были очень интересными, но результаты лечения прогерии не обязательно должны соответствовать результатам борьбы с естественным старением. И вот спустя пять лет тот же коллектив авторов опубликовал логичное продолжение своей работы, проведя эксперименты на двух линиях мышей, стареющих естественным образом. Оказалось, что и обычное старение организма можно отложить, если помогать организму устранять клетки с признаками клеточного старения.
Механизм, позволивший уничтожать у мышей стареющие клетки, довольно сложен. Кратко говоря, у этих животных можно запустить апоптоз — запрограммированную гибель тех клеток, где активно работает ген белка p16Ink4a. Для этого ученые получили линии мышей, в клетках которых есть генетические конструкции с таким же промотором, как у гена p16Ink4a. Когда этот ген в клетке активно действует, начинают работать и гены на синтетических конструкциях, введенных в клетки животных учеными. В число этих синтетических генов входят зеленый флуоресцентный белок, благодаря которому стареющие клетки становится видно невооруженным взглядом, и ген каспазы — фермента, запускающего апоптоз. Чтобы каспаза начала процесс апоптоза, ее молекулы должны объединиться в димеры.
Ген на синтетических конструкциях кодировал такой вариант каспазы, который димеризуется (соединяется в единый комплекс) только при наличии в среде определенного вещества — лекарства под названием AP20187. В итоге в стареющих клетках в результате работы гена белка p16Ink4a запускается блокировка клеточного цикла. Активность промотора этого гена запускает и синтез белков с синтетических конструкций — зеленого белка (окрашивающего стареющие клетки) и химерной каспазы. Каспаза может уничтожить клетки, в которых она нарабатывается, если мышам вводят лекарство AP20187. Получается, что у таких генетически модифицированных животных можно, во-первых, увидеть стареющие клетки, а во-вторых, эти клетки можно уничтожать, если давать животным лекарство.
Для испытания новой технологии в разных генетических контекстах ученые получали трансгенных лабораторных мышей с использованием двух разных линий. Оказалась, что эта схема, сложная в плане технической реализации, но простая по смыслу, на удивление эффективно помогает животным бороться со старением на уровне организма (рис. 1). Если годовалым мышам в течение шести месяцев вводили лекарство AP20187, то в их белом жире обнаруживалось в восемь раз меньше стареющих клеток, чем у мышей, которым вводили простой физраствор. Кроме того, состояние жировой ткани у экспериментальных мышей было более здоровым: в возрасте от одного года до полутора они не начинали терять жировые запасы, их адипоциты (клетки, из которых в основном состоит жировая ткань) не уменьшались, а гены наработки жира в них не начинали работать слабее, как это бывает у обычных мышей (рис. 2).

Рис. 2. Образцы двух типов жировой ткани у мышей 12- и 18-месячного возраста, которым давали (+AP) или не давали (–AP) лекарство AP20187. Интенсивность зеленой окраски отражает наработку одного из маркеров старения — β-галактозидазы (см. Beta-galactosidase). Длина масштабного отрезка — 5 мм.
Ученые понаблюдали за активностью p16Ink4a и других маркеров клеточного старения, а также синтетических генов и в других тканях подопытных животных. Во всех исследованных тканях мышей в возрасте от 12 до 18 месяцев росла активность маркера старения, но ее удавалось снизить, когда мышам давали лекарство. То, насколько слабела работа генов, связанных с клеточным старением, зависело от типа ткани. Значительный положительный эффект проявился для скелетной мускулатуры, тканей легких, сердца, почек, селезенки и глаз животных. Только в тканях кишечника и печени не обнаружилось снижения активности этих генов. Почему в этих органах метод ученых не дает положительного эффекта, пока непонятно, это будет интересно исследовать.
Хотя и не во всех тканях животных удалось запустить процессы уничтожения стареющих клеток, состояние подопытных мышей всё же улучшилось. У мышей обеих генетических линий средняя продолжительность жизни увеличилась на 17–35%. Для контроля ученые проверили, что у обычных, не модифицированных генетически, животных лекарство AP20187 не влияет на продолжительность жизни. К 22 месяцам генетически модифицированные мыши, которым давали лекарство, выглядели более здоровыми, чем мыши, которым вводили физраствор. Кроме того, они не утратили характерного для более молодых животных интереса к окружающему миру и так же часто проявляли исследовательское поведение.
Удаление стареющих клеток отложило у мышей формирование катаракты, а также улучшило работу почек и сердца (по сравнению с обычными мышами того же возраста). В почках при этом снизилось количество склеротических образований, а в сердце осталась неизменной масса левого желудочка, которая у стареющих мышей с возрастом уменьшается (рис. 3). В сердце, помимо этого, также не проявлялось обычного снижения активности генов, связанных с устойчивостью к стрессу. Благодаря этому мыши, у которых уничтожались старые клетки, лучше справлялись с аритмией, когда им вводили стимулирующие препараты. Наконец, удаление стареющих клеток увеличило продолжительность жизни даже тех животных, у которых развивался рак, хотя и не снизило частоту, с которой у животных появлялись опухоли.
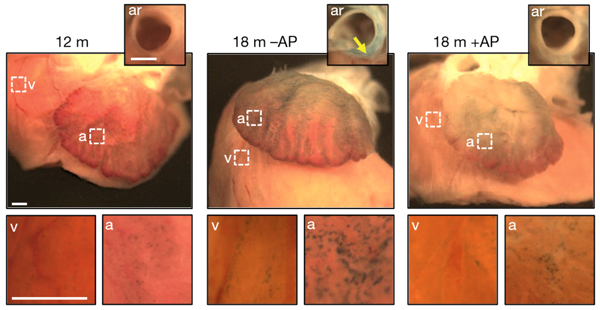
Рис. 3. Состояние сердца у мышей 12- и 18-месячного возраста, которым давали (+AP) или не давали (–AP) лекарство AP20187. Интенсивность зеленой окраски отражает наработку одного из маркеров старения — β-галактозидазы. v — желудочек, a — предсердие, ar — корень аорты. Длина масштабного отрезка — 1 мм.
Важно, что разработанная учеными методика не привела при этом к появлению ярко выраженных негативных эффектов. Ведь, согласно некоторым работам, стареющие клетки бывают полезны: например, они ускоряют заживление ран, а также ограничивают развитие фиброза. Поэтому были причины опасаться, что удаление старых клеток даст нежелательные побочные эффекты. К счастью, эксперименты показали, что при включении системы удаления стареющих клеток у мышей не возникает проблем с залечиванием ран. Возможно, это связано с тем, что система удаляет не все клетки с признаками старения (хотя и большую их часть).
Разумеется, подобные технологии когда-нибудь хотелось бы применить и для омоложения людей. Но перед этим потребуется провести еще множество тестов и исследований, ведь взаимосвязи клеточного старения и состояния организма у человека могут оказаться более запутанными и сложными, чем у мышей.
Источник: ЭЛЕМЕНТЫ БОЛЬШОЙ НАУКИ

