Каждый год, с завидной регулярностью, человечество сталкивается с большой и малоизученной опасностью. Непонятно откуда и по каким причинам вдруг появляются новые, неизвестные ранее виды вирусов, которые угрожают всем нам эпидемиями и гибелью большого количества людей. Так, появившийся весной 2015 года в Южной Корее ближневосточный респираторный коронавирусный синдром (коронавирус MERS) застал врасплох южнокорейские власти и заставил их принимать срочные эпидемиологические меры. Смертность от MERS составила более 35%, и, как сказано в бюллетене ВОЗ, «в настоящее время не существует ни конкретного лечения, ни вакцины от этой болезни». Поэтому интерес исследователей к вирусам вполне объясним и имеет жизненно важное значение.
Эволюция и происхождение вирусов
Как теперь известно ученым, вирусы окружают нас повсюду в живой природе. И каждая клетка каждого живого организма несет в себе следы прошлых встреч с ними. Генетическое разнообразие вирусов, их умение меняться и приспосабливаться, а также их огромное количество в природе — поражают. Предполагается, что общее число вирусных частиц на порядок выше количества всех клеток всех организмов на Земле. Миллионы лет назад ретроэлементы и ретровирусы участвовали в эволюции, выступая в качестве генетического резервуара для создания новых генов и усложнения видов. Этот вопрос подробно исследовали и нашли массу подтверждающих фактов российские генетики из Института биоорганической химии РАН (академик Е.Д. Свердлов, А.А. Буздин и их коллеги). И сейчас вирусы могут выступать одним из «орудий» эволюции, регулируя численность и жизнеспособность популяций.
Когда именно на Земле появились первые вирусы, наука точно сказать не может. Сегодня существует несколько гипотез происхождения вирусов. Один из самых авторитетных ученых-вирусологов, академик РАМН В.М. Жданов, особо выделяет три из них. Согласно первой, вирусы могут быть потомками бактерий или других одноклеточных организмов, претерпевших дегенеративную эволюцию. То есть бактерии или одноклеточные по каким-то причинам вместо обычного развития в сторону усложнения, потеряли часть структур и «упростились» до вирусов. Согласно второй гипотезе, вирусы появились еще до образования первых живых клеток и являются потомками древних доклеточных форм жизни. Возможно, поначалу они обладали автономностью, но затем перешли к паразитическому способу жизни, используя для своего размножения другие формы. Согласно третьей гипотезе, вирусы произошли от клеточных генетических структур — ретротранспозонов, — способных передвигаться в геномах.
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков?
Новосибирские микробиологи Игорь Бабкин и Ирина Бабкина из Института химической биологии и фундаментальной медицины РАН (ИХБФМ СО РАН), исходя из результатов геномного анализа называют более близкую к нам дату возникновения вируса натуральной оспы — 3000–4000 лет назад [8]. Место возникновения — восточная Африка. Но, так или иначе, вырвавшись с африканского континента около двух тысяч лет назад, вирус оспы начал свое «черное» шествие по миру, уложив в могилу огромное количество людей на всех континентах, и просуществовал до 1980 года, когда человечество объединенными усилиями его победило. Сегодня вирус натуральной оспы под строгим контролем сохраняется в двух лабораториях: в Центре по контролю заболеваний (CDC, Атланта, США) и в Научном центре вирусологии и биотехнологии «Вектор» (Кольцово, Россия).
Страхи-страхами, а престонские демоны волей-неволей и на благо науки работают — по крайней мере, у нас. В конце 90-х в микробиологических кулуарах ходила байка о том, что кое-какие — не известные широкой общественности — биологические институты выжили благодаря содержимому своих холодильников: чиновников удалось «разжалобить» только страшилкой об апокалиптических последствиях отключения электроэнергии в институте.
Строение вирусов и иммунный ответ организма
В поле зрения ученых вирусы попали в начале XVIII века. Тогда европейские врачи заинтересовались феноменом непроизвольной вакцинации: люди, зараженные легкой формой оспы — коровьей, — были не подвержены оспе натуральной, то есть человеческой. Прорыв в этом вопросе произошел в 1796 году, когда английский врач и ученый Эдвард Дженнер (рис. 1, справа) публично произвел первое «цивилизованное» и безопасное оспопрививание. После этого прошло без малого двести лет, когда в 1892 году впервые был описан вирус. Звание первооткрывателя вирусов по праву принадлежит российскому микробиологу Дмитрию Иосифовичу Ивановскому (рис. 1, слева), который в конце XIX века сумел описать вирус, вызывающий мозаичную болезнь растения табака. И вслед за этим открытием началось лавинообразное изучение вирусов, которые не перестают нас удивлять и преподносить неожиданные сюрпризы.
Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).
После детального изучения вирусов, которые получили свое название от латинского слова virus (яд), стало известно, как именно они устроены. Полноценная вирусная частица — вирион — состоит из белковой оболочки (капсида) и внутреннего содержимого: нуклеиновой кислоты, «хранящей» вирусные гены (рис. 2, 3). У некоторых вирусов капсид покрыт дополнительными слоями из белков и липидов. По тому, какая именно нуклеиновая кислота содержится в вирусе, их делят на два больших вида: ДНК- и РНК-вирусы.
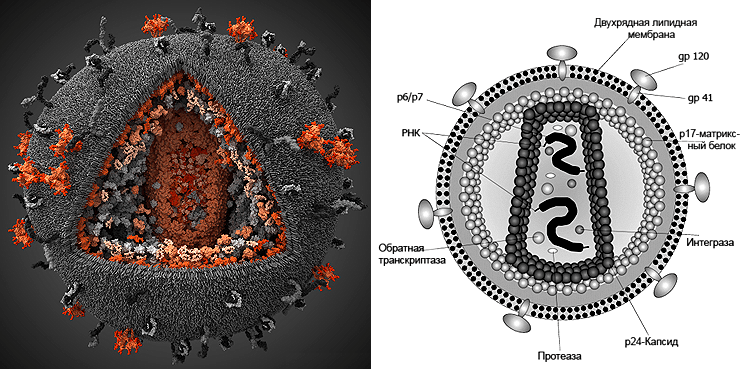
Рисунок 2. Строение вируса иммунодефицита человека (ВИЧ). Диаметр частицы ВИЧ составляет примерно 100–120 нм. gp120 — поверхностный белок, молекулы которого формируют «шляпку гриба». Именно этот белок взаимодействует с антителами и рецептором клетки-мишени (gp — гликопротеин, 120 — масса белка в дальтонах). gp41 — белок, формирующий «ножку гриба», встроенную в липидную мембрану вируса. р24 — внутренний белок, две тысячи молекул которого составляют капсид вируса (кор), имеющий форму усеченного конуса. р17 — матриксный белок, образующий слой толщиной 5–7 нм между внешней оболочкой и капсидом. Интеграза, ревертаза и протеаза — ферменты, необходимые для жизненного цикла вируса. РНК (2 копии) — хранилище генетической информации (ВИЧ — ретровирус). Генетический аппарат ВИЧ-1, связанный с нуклеокапсидным белком p7, имеет длину около 10 тыс. нуклеотидов и содержит девять генов.
Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор.
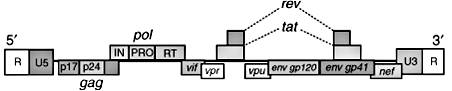
Рисунок 3. Генетическая организация вируса ВИЧ-1. (+)РНК-геном вируса содержит гены, ответственные за синтез белков, выполняющих структурные, ферментативные и регуляторные функции. Это гены gag, env и pol, имеющиеся у всех известных ретровирусов и кодирующие структурные белки оболочки вируса (gag, env), а также ферменты: ревертазу, интегразу и протеазу (ген pol). Оставшиеся шесть генов — vpr, vpu, vif, tat, rev, nef — так или иначе участвуют в жизненном цикле ВИЧ-1, кодируя регуляторные белки и подавляя активность иммунных клеток. Два вида вируса иммунодефицита человека (ВИЧ-1 и ВИЧ-2) различны по составу генов: у ВИЧ-2 нет гена vpu, зато есть ген vpx.
Что происходит после того, как вирус попадает внутрь организма? Уже в слизистой оболочке иммунные клетки (макрофаги) поглощают часть вирионов. Вслед за этим, когда вирус проникает в кровь, другие иммунные клетки — Т-хелперы — дают стимулирующий сигнал «убийцам» вирусов: B-лимфоцитам и Т-киллерам. Операция по уничтожению вируса переходит в следующую фазу. Активированные B-лимфоциты образуют антитела, которые находят свободные антигены вирусов и связываются с ними. Такой тандем (вирусный антиген — антитело) захватывается и уничтожается макрофагами. Те вирусы, которые сумели ускользнуть от антител и макрофагов и внедриться в клетки, уничтожаются вместе с пораженными клетками Т-киллерами. И завершающий этап иммунной реакции: клетки Т-супрессоры гасят активность иммунного ответа, прекращая агрессивные действия Т-киллеров и B-лимфоцитов, чтобы те, разбушевавшись, не уничтожили и здоровые клетки.
Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).
В 2008 году американские исследователи из Университета Рокфеллера открыли еще один интерферон-зависимый антивирусный механизм. Выяснилось, что интерферон стимулирует синтез белка BST-2 (тетерина), блокирующего выход вирионов из клетки. Но некоторые вирусы научились обходить действие интерферона. Так, вирус Эбола (рис. 4) с помощью своего белка eVP24 не дает ядерному фактору PY-STAT1 проникнуть в ядро и запустить действие интерферона. У этого вируса есть еще несколько механизмов, делающих его неуязвимым для иммунитета. Так, внутреннее содержимое вируса окружено «чехлом» из полисахаридов, благодаря чему вирус плохо распознается иммунной системой.
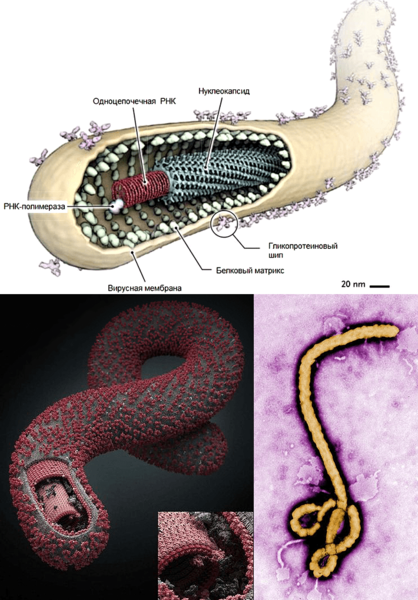 Рисунок 4. Схема строения, 3D-модель и фото вируса Эбола.
Рисунок 4. Схема строения, 3D-модель и фото вируса Эбола.
Как мы видим, в идеале у здорового организма существует довольно надежная многоуровневая система защиты от проникновения всевозможных «чужаков». И действительно, все мы знаем, что встречаются люди, в силу своего крепкого здоровья устойчивые ко всяким сезонным инфекциям вроде ОРВИ или гриппа. Такой опасный агент, как вирус натуральной оспы, не убивал всех без исключения заразившихся, и большая часть заболевших выздоравливала своими силами. Среди них был и будущий глава СССР, И. Сталин, переболевший в детстве оспой. Даже лихорадка Эбола, наводящая сегодня ужас в Африке, оставляет в живых десятую часть заразившихся. И лишь по отношению к одной единственной инфекции эта система защиты оказывается бессильной в 100% случаев заражения. Ни один человек из 36,9 миллионов, инфицированных ВИЧ (данные ВОЗ на начало 2015 г.), не смог избавиться от вируса, за одним единственным исключением «берлинский пациент».
Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.
Почему же человечество со всем своим огромным научным и техническим потенциалом ничего не может противопоставить этой смертоносной инфекции? Проблема борьбы с ВИЧ многоуровневая и включает в себя несколько факторов. Так, неизвестно почему, но иммунная система человека вместо того, чтобы бороться с вирусом, иногда помогает ему. Этот феномен, получивший название антителозависимое усиление инфекции (ADE), был описан применительно к ВИЧ в конце 80-х годов американскими биологами из университетов Калифорнии и Вандербильта — В. Робинсоном и его коллегами. Было обнаружено, что антитела, которые вырабатываются в организме в ответ на вирусную атаку, облегчают проникновение вируса в клетку (рис. 5, 6). Посредством специфического участка — Fc-области — они присоединяются к клеткам-фагоцитам и «проводят» вирус в них. Это похоже на то, как поводырь проводит плохо видящего человека в нужное место: антитело «берет за руку» вирус и заводит его в макрофаг.
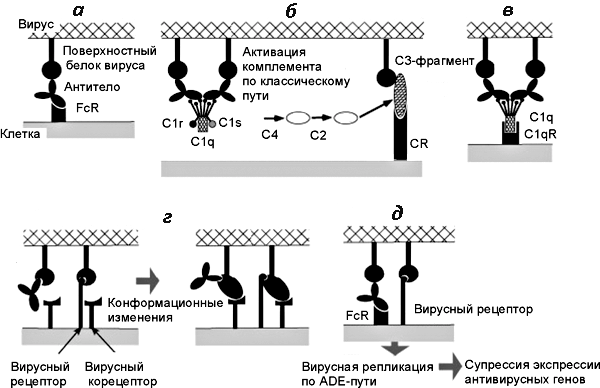
Рисунок 5. Схема развития феномена ADE при вирусных инфекциях. а — Взаимодействие между антителом и рецептором FcR на поверхности макрофага. б — Фрагмент С3 комплемента (компонент комплемента, после присоединения которого весь этот комплекс приобретает способность прилипать к различным частицам и клеткам) и рецептор комплемента (complement receptor, CR) способствуют присоединению вируса к клетке. в — Белки комплемента С1q и С1qR способствуют присоединению вируса к клетке (в составе молекулы C1q имеется рецептор для связывания с Fc-фрагментом молекулы антитела). г — Антитела взаимодействуют с рецептор-связывающим сайтом вирусного белка и индуцируют его конформационные изменения, облегчающие слияние вируса с мембраной. д — Вирусы, получившие возможность реплицироваться в данной клетке посредством ADE, супрессируют противовирусные ответы со стороны антивирусных генов клетки.
Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.
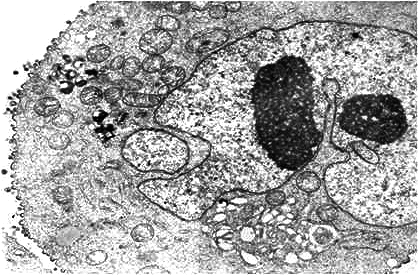
Рисунок 6. Электронно-микроскопическая фотография макрофага, инфицированного ВИЧ-1. Две темные области — многочисленные вирусные частицы, которыми «нашпигована» клетка.
Но и это еще не все уловки в арсенале смертоносной инфекции. В нашем организме существуют специальные антиретровирусные системы, которые должны противостоять ВИЧ. Сегодня известны три таких системы: упоминавшийся выше (в связи с интерфероном) BST-2/ тетерин, а также AID/APOBEC и TRIM5-α. Но, как выяснилось, все они оказываются бессильны в борьбе против ВИЧ. Вот как об этом говорит М.Р. Бобкова из Института вирусологии им. Д.И. Ивановского: «Антивирусные системы клетки, получившие название „внутреннего иммунитета“ (intrinsic immunity), пытаются бороться с вирусом, но у них это плохо получается. APOBEC модифицирует вирусную ДНК таким образом, что это приводит к ее разрушению либо неполноценности. В ответ на это вирус ВИЧ приобрел белок Vif, блокирующий функцию APOBEC. TRIM5-α у обезьян хорошо справляется с функцией преждевременного „раздевания“ РНК вируса, но только не „своего“ вида, а всех других. У человека этот белок есть, но функция его снижена, и ее недостаточно для ограничения репликации (копирования) ВИЧ. Тетерин связывает отпочковывающиеся вирусные частицы и не дает им покинуть поверхность клетки. В противодействие этому у ВИЧ есть белок Vpu, который путем связывания тетерина „освобождает“ новые частицы. Представить себе, что эти механизмы защиты от внутреннего иммунитета вирус выработал за те несколько десятилетий, что он общается с человеком, невозможно, поэтому должно быть какое-то другое объяснение».
«Другое» объяснение приводит в своей работе известный специалист по ВИЧ, микробиолог Михаил Супотницкий. По его мнению, причина того, что антивирусные системы человека бессильны против ВИЧ, носит эволюционный характер: «Почему так работают антиретровирусные системы человека? Причина, скорее всего та же, что заставляет иммунную систему человека участвовать в размножении и распространении ВИЧ — эти системы созданы самими ретровирусами». Когда-то, несколько сотен миллионов лет назад, древние ретроэлементы, от которых произошли все ретровирусы, участвовали в процессе эволюции в формировании иммунной системы позвоночных, передав для ее генов некоторые свои элементы. И потому наша иммунная система, созданная ретроэлементами, иногда может по старой памяти воспринимать вирусы как «своих».
Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.
Также известно, что ВИЧ в своем жизненном цикле задействует множество белков организма хозяина (рис. 7). В 2008 году ученые из Гарвардской медицинской школы и Института Говарда Хьюза посредством механизма РНК-интерференции провели исследование генома человека на предмет обнаружения белков-«коллаборационистов», сотрудничающих с ВИЧ. В ходе работы ими были обнаружены 273 белка, так или иначе связанных с циклом ВИЧ. Но и это еще не всё. Оказалось, что наши внутренние, эндогенные ретровирусы, тихо сидящие в нашей ДНК, могут в случае надобности предоставлять «чужим» ретровирусам (в том числе и ВИЧ) свои ферменты, необходимые для вирусного жизненного цикла. То есть внутренние и внешние вирусы взаимодействуют между собой: американскими исследователями был зафиксирован феномен, когда в ответ на прием ингибиторов протеаз протеаза эндогенного ретровируса человека HERV-К компенсировала своим действием отсутствие этого фермента у ВИЧ-1. Получается такая «дружеская взаимопомощь» между вирусами. Hе случайно авторитетный вирусолог, академик РАН Е.Д. Свердлов назвал наши эндогенные ретровирусы «пятой колонной» ВИЧ. В свою очередь, ВИЧ может активизировать «дремавшие» эндогенные ретровирусы: наблюдали усиление экспрессии генов ретровируса HERV-K10 у ВИЧ-инфицированных и появление в сыворотке крови таких людей вирусных частиц HERV-K.
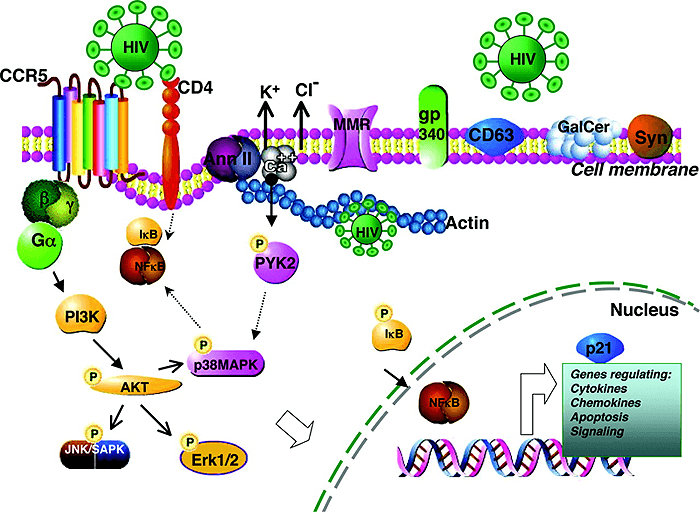
Рисунок 7. Изображение участка мембраны макрофага, способного к взаимодействию с ВИЧ. В дополнение к каноническим рецепторным структурам типа CD4 и CCR5/CXCR4 (имеющимся у Т-хелперов), мембрана макрофага имеет дополнительные молекулярные структуры, позволяющие вирусу эффективно узнавать макрофаг, присоединяться к его наружной поверхности и проникать внутрь клетки. Они играют важную роль в сигнальных клеточных актах, лежащих в основе жизненного цикла вируса. Взаимодействие гликопротеина gp120 ВИЧ с CCR5 приводит к сигнальной трансдукции, активирующей PI-3K (PI — ингибитор протеазы). PI-3K в свою очередь активирует серин/треонин-протеинкиназу (serine/threonine protein kinase, AKT). Далее запускается каскад реакций фосфорилирования, формирующих связи между транскрипционными актами. Аннексин (annexin II, Ann II) — это кальцийсвязывающий белок (Ca++-binding protein), он взаимодействует с фосфатидилсерином (phosphatidylserine) Env ВИЧ, участвует в актин-цитоскелетных перестановках (actin cytoskeletal rearrangement) и в транспорте вируса внутрь макрофага. Актин и аннексин II «вовлекают» вирус в эндосомальный компартмент, где он чувствует себя «как дома». В «узнавании» ВИЧ также участвуют маннозный рецептор макрофага (macrophage mannose receptors, MMR), gp340, CD63, галактозилцереброзид (galactosylcerebroside, GalCer) и синдекан (syndecan, Syn). Пунктирные стрелки относятся к путям, предполагаемым для Т-клеток. Pyk2 (proline-rich tyrosine kinase-2) — пролин-обогащенная тирозинкиназа-2; SAPK (stress-activated protein kinase) — стресс-активированная протеинкиназа.
Существует одна схожая особенность многих опасных вирусов, затрудняющая вакцинацию и лечение: они чрезвычайно быстро меняются. У ВИЧ это обусловлено тем, что фермент обратная транскриптаза делает массу ошибок при копировании вируса в организме — такая у этого фермента особенность. И потому вирусные копии отличаются одна от другой, и вирус становится неуловимым. Это похоже на то, как если бы полиция искала преступника по фотороботу и отпечаткам, а он каждый день менял свой облик, да еще и делал себе двойников. У других вирусов есть свои механизмы изменчивости. К примеру, два знаменитых филовируса — Эбола и Марбурга — с момента открытия изменились по составу аминокислот в некоторых белках более чем на 20%! Вирус гриппа постоянно меняется благодаря двум своим специфическим особенностям: «антигенному дрейфу» и «антигенному шифту» — мутации антигенов вируса и полной замене одного из генов.
Эпидемии «медленных» вирусов и вирусная эволюция
Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека.
Конечно, атипичная пневмония, «птичий» грипп, коронавирус MERS и другие, неизвестные пока инфекции при определенных обстоятельствах могут вызвать эпидемии с большими человеческими жертвами. Природный резервуар «запасных» частей для вирусов огромен, и они могут складываться в опасные формы. Этот процесс носит название рекомбинация вирусов — вирусы обмениваются своими «запасными» частями (генами) друг с другом и с носителями, создавая новые виды. И именно после этого появляются новые опасные формы вирусов, о которых мы регулярно узнаем из новостных лент СМИ.
Причем больших изменений для возникновения опасной формы вируса не требуется. Так, «испанский» грипп, от которого в 1918-1920 гг. погибло более 20 млн человек, был вызван вирусом типа H1N1 (рис. 8), доставшимся человеку от птиц. В конце 90-х гг. американские ученые из Armed Forces Institute of Pathology исследовали этот вирус, выделив его из тел, похороненных на Аляске, и нашли всего лишь одно существенное изменение, сделавшее его смертельным: изменение в гене поверхностного белка — нейраминидазы. В 2008 году ученые из Массачусетского технологического института — Т. Тампи и его коллеги — дополнили эти исследования, обнаружив еще две возможные мутации, которые могли сделать этот вирус «массовым убийцей»: мутации в структуре второго поверхностного белка вируса гриппа — гемагглютинина, — которые позволили ему связываться со специфическими гликанами человеческих эпителиальных клеток (рецепторами α2—6).
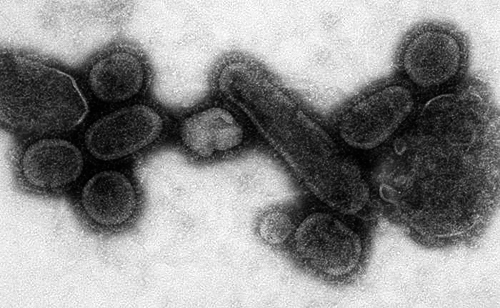
Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Всё тот же научный прогресс стал причиной односторонней миграции населения из сёл и малых городов в крупные города, что привело к возникновению компактных многомиллионных поселений. Чего не было за всю длинную эволюцию человека. И такая скученность населения в крупных городах создает все условия для возникновения и распространения новых форм вирусов: ослабление иммунитета как следствие загрязненной среды обитания и стрессов и возможность скорейшего инфицирования всё новых и новых хозяев. Академик В.А. Кордюм приводит пример с вирусом герпеса человека 7-го типа (ВГЧ-7) и цитомегаловирусом. Эти два инфекционных агента распространены повсеместно: ими инфицировано большинство населения Земли. И пока человек живет в нормальных условиях, они никак себя не проявляют. Но стоит лишь иммунитету ослабеть — вследствие стресса или других факторов — ВГЧ-7 и цитомегаловирус активизируются, еще более угнетая иммунную систему и «открывая ворота» для других, более опасных вирусов.
Ясно, что мы пока не до конца понимаем причины стремительной эволюции вирусов и те природные механизмы, которые способствуют этому. Очевидно, что наш современный «урбанистический» образ жизни играет в этих процессах не последнюю роль. Человек, устраивая свою жизнь с комфортом и переделывая всё вокруг на свой вкус и под свои нужды, вдруг забыл, что он обычный биологический вид и перестал жить по законам природы. А вирусы напоминают нам об этом.
Источник: БИОМОЛЕКУЛА

