В последнее десятилетие публиковалось много материалов, посвященных революционной технологии перепрограммирования соматических клеток в омоложенные стволовые клетки, называемые индуцированными плюрипотентными стволовыми клетками (ИПСК). Казалось бы, человечество получило фонтан вечной молодости и здоровья. Однако врачи не спешат использовать эти чудесные клетки для исцеления больных, так как лечение с их помощью оказалось сопряжено с риском заболеть раком. Как же надежно обезопасить пациентов, которые нуждаются в терапии клетками, полученными из ИПСК? Этот миниобзор посвящен новейшим разработкам и достижениям в решении этой задачи.
Долгое время трудности выделения стволовых клеток из человеческого организма и отсутствие качественных методов их размножения в культуре сдерживали прорыв в клеточной терапии. Однако не так давно миру была представлена революционная технология перепрограммирования соматических клеток в омоложенные стволовые, называемые индуцированными плюрипотентными стволовыми клетками (ИПСК). Главные ее возможности — «размножение» стволовых клеток и превращение их в различные специализированные клетки, да к тому же попутно (при необходимости) осуществление генной терапии для исправления мутантных генов.
Более того, оказалось, что с помощью перепрограммирования в ИПСК можно получать из клеток старых и даже суперстарых (столетних) пациентов полностью обновленные стволовые клетки, способные дифференцироваться в молодые соматические клетки. Поэтому технологию получения ИПСК следует рассматривать еще и как способ радикального омоложения. Предполагается, что с помощью этих клеток можно будет бороться с заболеваниями, ранее считавшимися неизлечимыми. Так, например, полученные из ИПСК омоложенные клетки мезенхимы можно будет применять для лечения сердца, почек, нервной ткани, суставов, для регенерации костей и терапии воспалительных заболеваний, а также для подавления реакции отторжения при трансплантации, поскольку они мало чем отличаются от стволовых клеток из ткани костного мозга.
Несмотря на эти и множество других свидетельств благоприятного (лечебного) воздействия клеток, полученных из ИПСК, в клинике они пока не взяты «на вооружение», так как для их использования в терапевтических целях есть серьезные препятствия — опасность формирования опухолей и иммуногенность плюрипотентных клеток. Инъекция пациенту его же собственных ИПСК обычно приводит к иммунной реакции, препятствующей их приживлению, или даже к образованию опухолей типа тератомы. Такая способность ИПСК образовывать опухоли связана со сбоем механизма эпигенетической перестройки, а не с необратимыми генетическими мутациями, и может быть предсказана по активации определенных сигнальных путей.
Этот онкогенный и иммуногенный потенциал, как выяснилось, обычно обусловлен присутствием недифференцированных ИПСК. Поэтому перед использованием этих клеток в терапии важно не только провести полную дифференцировку всех ИПСК, но и тщательно очистить материал, предназначенный для трансплантации, от плюрипотентных клеток. Было разработано множество методов подобной очистки, значительно снижающих риск образования опухоли. Тем не менее даже самая изощренная предварительная очистка не способна обезопасить подсадку материала, полученного из ИПСК, так как после избирательного удаления плюрипотентных клеток они могут появиться вновь путем превращения дифференцированных клеток обратно в стволовые (к чему может подтолкнуть, например, гипоксия). И из-за этого снова возникает риск образования опухоли. Обычно такие опухоли обнаруживают не сразу, а только при длительном наблюдении.
Поскольку причиной таких спонтанных переходов может быть геномная нестабильность полученных ИПСК, важно снизить в них уровень повреждений ДНК и количество геномных перестроек, ограничив вызываемый перепрограммированием репликативный стресс — например, за счет повышения уровня чекпоинт-киназы 1 (CHK1) и добавления в среду для перепрограммирования свободных нуклеозидов.
Чтобы защитить организм от риска, связанного с возможностью образования опухолей при клеточной терапии с использованием ИПСК или полученных из них дифференцированных клеток, необходим аварийный предохранитель, позволяющий с большой надежностью избавляться от этих клеток, если что-то пошло не так.
Таким предохранителем мог бы быть избирательный апоптоз всех клеток, полученных из ИПСК, — такой, при котором остальные клетки организма не испытывали бы сильную интоксикацию.
С этой целью была создана система активации апоптоза на базе гена тимидинкиназы (ТК) вируса простого герпеса (ВПГ) и довольно токсичного и мутагенного препарата ганцикловира, аналога гуанина. При воздействии ТК-ВПГ ганцикловир фосфорилируется в монофосфат, который клеточные киназы затем превращают в трифосфат. Последний ингибирует синтез ДНК, конкурентно подавляя ДНК-полимеразу. Особенностью этой системы является то, что апоптоз наблюдается только в делящихся клетках. Чтобы апоптоз затрагивал не все делящиеся клетки, а лишь плюрипотентные, с характерными только для них регуляторами транскрипции, в качестве промотора для гена ТК-ВПГ используют промоторы генов транскрипционных факторов Oct-4 или Nanog. Опухоли, образующиеся из таких модифицированных плюрипотентных стволовых клеток, можно ингибировать введением ганцикловира. Однако недостатком такой системы является то, что она позволяет выжить медленно делящимся клеткам, из-за чего лечение токсичным и мутагенным препаратом приходится растягивать на длительное время, а это снижает шансы на успешное лечение.
В качестве альтернативы была разработана другая система активации апоптоза. Чтобы сделать применение ИПСК в клинике безопасным, было предложено одновременно с перепрограммированием клеток пациента вводить в них на той же кассете, что и перепрограммирующие факторы, ген индуцируемой каспазы 9 (iCasp9). Генно-инженерная каспаза 9 активируется препаратом (AP1903 или AP20187), вызывающим димеризацию ее молекул. В результате в 94–99% клеток, содержащих iCasp9, начинается апоптоз, приводящий к гибели этих клеток (рис. 1).
Методика была первоначально разработана для быстрого удаления терапевтических аллогенных Т-клеток в случае развития у пациента реакции «трансплантат против хозяина» во время лечения лейкемии. Она позволила применять существенно более высокие концентрации Т-клеток, не опасаясь за последствия: однократной инъекции индуктора димеризации было достаточно, чтобы за полчаса разрушить клетки, содержащие ген iCasp9.
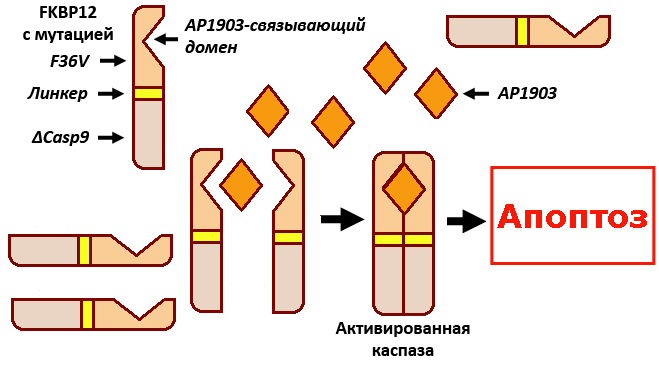
Рисунок 1. Модель системы индуцируемого апоптоза. Ген «клеточного самоубийства» iCasp9 был сконструирован из ДНК-последовательностей, кодирующих: 1) такролимус-связывающий домен димеризации FKBP12 с мутацией F36V, повышающей сродство; 2) линкерную последовательность аминокислот (Ser—Gly—Gly—Gly—Ser), которая обеспечивает гибкость конструкции; 3) человеческую каспазу 9, лишенную домена физиологической димеризации (ΔCasp9). Благодаря такой конструкции димеризация генно-инженерного белка iCasp9, необходимая для индукции ферментативной активности, происходит только при добавлении малой синтетической молекулы (например, AP1903), взаимодействующей с доменом FKBP12. Таким образом, для «включения» ферментативной активности каспазы, запускающей каскад апоптоза, не нужна инициация через предварительный митохондриальный путь апоптоза — его заменяет димеризующая каспазу молекула. Такой «предохранитель» позволит избавляться от омоложенных клеток после того, как они выполнили свою терапевтическую функцию или в случае образования из этих клеток опухоли.
Помимо быстроты излечения, важным преимуществом этой системы является низкая токсичность димеризующего препарата, а также то, что он (в случае AP1903) не используется в какой-либо иной терапии или в пищевых продуктах. По предварительным данным, введение гена iCasp9 в ИПСК никак не отражалось на их плюрипотентности: сохранялась способность и к пролиферации, и к дифференцировке в клетки всех трех зародышевых листков.
Поскольку удаление клеток с помощью индуцируемого апоптоза всё же не было 100-процентным — возможно, из-за активации антиапоптозных белков вроде Bcl-2 — необходимо дальнейшее совершенствование системы аварийной безопасности ИПСК, основанной на суицидных генах. Это позволит приблизить время, когда омоложенные стволовые клетки можно будет широко применять для лечения людей.
Источник: БИОМОЛЕКУЛА

