Рис. 1. Модель вируса гепатита C
Вирусом гепатита C заражено уже около 3% населения Земли, и количество заболевших растет. Коварство вируса состоит в том, что болезнь часто начинается практически без симптомов, но затем переходит в хроническую форму и заканчивается циррозом или раком печени. В последнее время разработаны достаточно эффективные противовирусные средства, но они очень дороги и не дают гарантии от рецидива. Вакцины против вируса пока нет.
Вирус гепатита C (Hepatitis C virus, HCV) — один из пяти известных к настоящему времени вирусов (гепатиты A, B, C, D и E), вызывающих гепатит — поражение печени. К началу 70-х годов ХХ века были открыты и в значительной мере изучены вирусы гепатитов А и В, но затем стали появляться данные о том, что существует еще какой-то вирус гепатита — «не А и не В». В восьмидесятые годы этот вирус был найден и охарактеризован; его назвали гепатитом C. В настоящем обзоре будет кратко рассказано об особенностях и о некоторых недавних успехах в борьбе с этим опасным заболеванием.
Вирус гепатита C — тихий убийца
По данным Всемирной организации здравоохранения, гепатитом C в мире болеют 130–150 млн человек и ежегодно им инфицируются 3–4млн человек. Каждый год от связанных с гепатитом C болезней печени умирают примерно 500 000 человек. Географическое распространение HCV среди населения Земли неравномерно. В Центральной и Восточной Азии, в Северной Африке, на Ближнем Востоке им заражено более 3,5% населения, в Южной и Юго-Восточной Азии его распространенность составляет 1,5–3,5%, в других регионах она ниже (рис. 2).
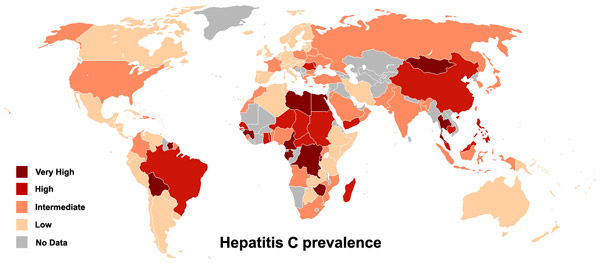
Рис. 2. Зараженность населения вирусом гепатита C в различных регионах Земли. Чем темнее оттенок красного, в который окрашена область на карте, тем больший процент населения заражен гепатитом на этой территории. Серым покрашены страны, данных по которым нет.
Особенно высока зараженность HCV в Египте (22%), в Пакистане (4,8%) и в Китае (3,2%). (Такой высокий уровень зараженности в Египте, вероятно, связан с массовой кампанией по лечению шистосомоза, в ходе которой нарушались требования к стерильности используемых шприцов.) В связи с тем, что долгое время болезнь может протекать без симптомов, ее диагностирование затруднено. Считается, что в развитых странах выявляется примерно половина зараженных, но в среднем этот показатель не превышает 5%.
У вируса гепатита C пути распространения и механизмы заражения примерно такие же, как у вируса иммунодефицита человека. Гепатит передается исключительно через кровь. Поэтому особую группу повышенного риска (как и для ВИЧ) представляют наркоманы, пользующиеся одним шприцем. Но заразиться можно и в больнице, если не соблюдаются элементарные правила стерилизации медицинского инструмента, в результате переливания крови, не прошедшей соответствующую проверку, при нанесении татуировок и даже на приеме у зубного врача.
HCV поражает прежде всего гепатоциты — клетки печени. Реже он может поражать стенки кровеносных сосудов, вызывать расстройства центральной нервной системы. Коварство вируса состоит в том, что поначалу симптомы заболевания часто либо отсутствуют, либо слабы и невыразительны: потеря аппетита, утомляемость, мышечная слабость, депрессия. Иногда человек может жить с этим вирусом десятилетия и лишь при случайном обследовании узнает, что он заражен. Опасность же представляет свойство инфекции HCV примерно в 80% случаев переходить в хроническое состояние, которое часто заканчивается циррозом или раком печени.
Диагностика гепатита C проводится путем прямого обнаружения вирусной РНК с помощью полимеразной цепной реакции, которая становится возможной через 1–2 недели после заражения, или с помощью иммунологического определения антител к HCV, проявляющихся позже. Неспецифическая диагностика может осуществляться путем отслеживания уровня ферментов печени, но во многих случаях он не отличается от нормы.
Враг крупным планом
Генетический материал HCV заключен в икосаэдрический белковый капсид, окруженный липидной оболочкой (рис. 3). В эту оболочку встроены гликопротеины, участвующие во взаимодействии с рецепторами поверхности клетки.
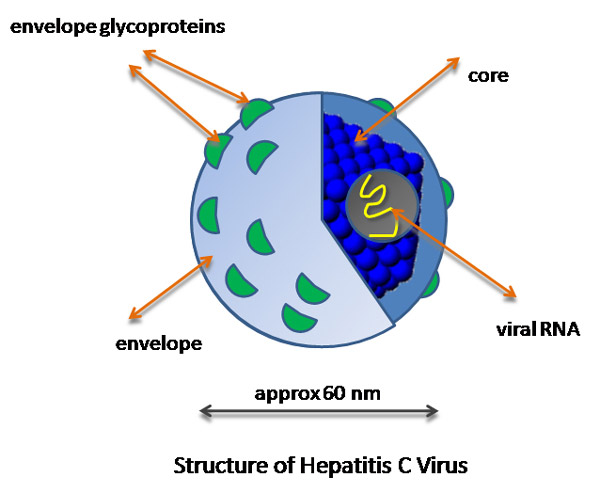
Рис. 3. Схема строения вируса гепатита C. Генетическая информация вируса хранится в РНК, которая заключена в белковый капсид (показан составленным из синих шариков), имеющий форму икосаэдра. На липидной оболочке вируса (envelope) расположены гликопротеины (зеленые), помогающие вирусу прицепляться к клетке-жертве.
После адсорбции на клетке вирус «проглатывается», тем самым проникая внутрь, и освобождает свой геном (рис. 4).
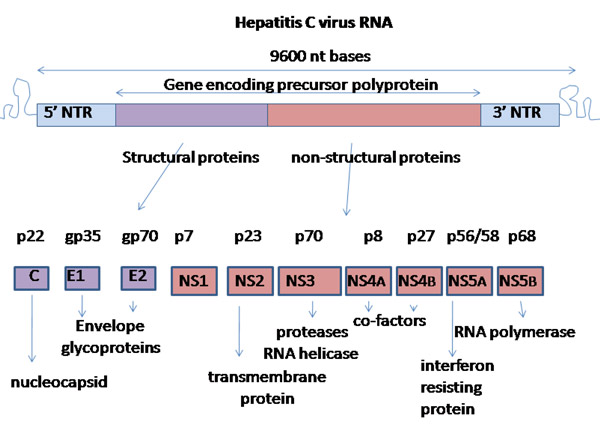
Рис. 4. Экспрессия генома вируса гепатита C. Вирусная РНК прочитывается в виде одного большого полипептида (Gene encoding precursor protein), который затем расщепляется на структурные и неструктурные вирусные белки.
Геном HCV представляет собой однонитевую РНК, составленную из примерно 9600 нуклеотидов. Механизм экспрессии генетической информации HCV довольно необычен. Его РНК кодирует очень длинный полипептид (длиной около 3000 аминокислотных остатков). Клеточные и вирусные протеазы расщепляют этот полипептид на 3 структурных белка, которые затем войдут в состав зрелого вируса, и 7 неструктурных белков, обеспечивающих репликацию HCV (рис. 5). Вирусная РНК реплицируется одним из неструктурных белков — РНК-зависимой РНК-полимеразой. Вирусные частицы-потомки формируются на внутриклеточных мембранах и выходят из клетки.
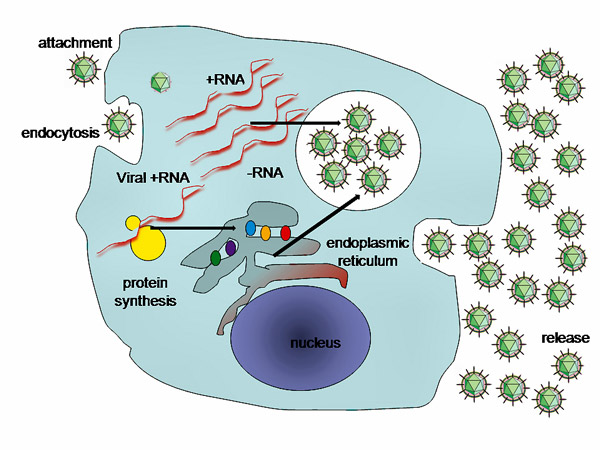
Рис. 5. Схема репликации вируса гепатита C. Процесс идет слева направо. Сначала вирусная частица прицепляется к поверхности клетки (attachment). Затем клетка поглощает её (endocytosis) и вирус проникает в клетку. После чего вирус высвобождает свою РНК и вынуждает клетку заниматься размножением своей генетической информации, в результате клетка «штампует» необходимые для сборки новых вирусных частиц блоки. Новое поколение вирусов покидает клетку и выносится в ток крови в поисках новых клеток-жертв (release).
Гепатиту C свойственно высокое генетическое разнообразие. Известно 6 основных генотипов вируса и около 90 подтипов.
Существующие методы борьбы с гепатитом С
Абсолютно надежных методов лечения вирусной инфекции HCV не существует. Обычно HCV лечат комбинацией интерферона с лекарственным препаратом рибавирином. В результате такого лечения выздоравливают 50–80% зараженных. В последнее время появились новые препараты, непосредственно воздействующие на вирусспецифические ферменты и на репродукцию вируса. Эти препараты заметно повышают эффективность терапии (почти до 100%), но они очень дороги. Так, курс лечения софосбувиром — ингибитором вирусной РНК-полимеразы — стоит 50–100 тысяч долларов. В России и в ряде других стран зарегистрирован другой препарат — телапревир (telaprevir). Он представляет собой ингибитор вирусспецифической протеазы и также подавляет репродукцию HCV. Но телапревир тоже достаточно дорог, курс лечения им стоит несколько тысяч долларов. Многие больные по всему миру из-за дороговизны препарата покупают дженерики софосбувира в Индии, Китае и Египте, где цена на них (за 3-х месячный курс лечения) находится в районе 500-1000 долларов (прим. ред.).
Здесь следует заметить, что высокие цены на эти и другие лекарства объясняются не жадностью фармацевтических компаний. Львиную долю цены часто составляет компенсация затрат на разработку и испытание препаратов.
Успех лечения с применением той или иной терапии зависит от генотипа вируса. Но при этом после выздоровления, о котором обычно судят по исчезновению вирусной РНК в крови, достаточно часто возникает рецидив заболевания, а успешное лечение не исправляет повреждения печени. Оно лишь стабилизирует ее состояние и не гарантирует от дальнейшей прогрессии этой патологии. Поэтому необходимо постоянное наблюдение за состоянием печени — особенно из-за того, что может развиться цирроз и рак.
Практика показывает, что существуют серьезные проблемы с идентификацией инфекции HCV до того, как возникнут тяжелые поражения печени. Кроме того, возможно повторное заражение, а также развитие устойчивости к терапии. Стоимость лечения высока, а уже развившиеся тяжелые поражения печени лечить почти невозможно. Поэтому максимальный эффект в плане снижения смертности, связанной с HCV, может дать разработка мер против хронической инфекции. Наиболее эффективной мерой может быть вакцинация — если и не поголовная, то хотя бы тех, кто относится к группам повышенного риска (в первую очередь наркоманов).
На пути к созданию вакцины
Попытки создать вакцину против HCV начались практически сразу после открытия вируса. Но в отличие от вирусов гепатитов А и В, для которых хорошие вакцины уже довольно давно разработаны и доказали свою эффективность, с HCV ситуация оказалась значительно сложнее. Дело в том, что РНК-зависимая РНК-полимераза HCV при копировании вирусного генома допускает много ошибок (в отличие, например, от ДНК-полимеразы клеток). Этим, в частности, объясняется отмеченное выше разнообразие генотипов HCV. Последовательности нуклеотидов в геномах различных генотипов могут различаться до 30%.
Но на пути разработки такой вакцины возникает и множество других препятствий. Например, отсутствие доступных и адекватных моделей для испытания вакцин. Из животных моделей HCV заражает только высших приматов (шимпанзе), содержание и работа с которыми в лабораторных условиях трудны и чрезвычайно дороги. Ученые пытаются использовать и других животных для изучения гепатита C, но на этом направлении существенных успехов пока не достигнуто.
Вакцинация ослабленным вирусом чревата превращением его в активный, и такие исследования сочли бесперспективными. Первые исследования по разработке вакцин против HCV проводились традиционным путем с помощью введения структурных белков вируса для наработки антител, способных инактивировать HCV. Но вакцинация очищенными или искусственно полученными структурными вирусными белками или пептидами, содержащими участки узнавания антител, оказалась неэффективной. Вирус уклоняется от вырабатываемых антител к этим белкам, меняя последовательность нуклеотидов в кодирующих их генах и, следовательно, аминокислотную последовательность белков. Так, сообщалось об испытаниях комбинированной вакцины, индуцирующей иммунитет полученными с помощью методов генной инженерии поверхностными структурными белками (точнее, гликопротеидами) Е1 и Е2, а также белка капсида, окружающего вирусный геном. По предварительным данным, эта вакцина вызывала активную выработку нейтрализующих антител. Уже довольно давно сообщалось об испытаниях этой вакцины, но в медицинскую практику она пока не поступила.
В то же время имеются достоверные данные о людях, которым уже свойственен протективный иммунитет к HCV. Примерно 25% зараженных способны спонтанно излечиваться от вирусной инфекции. Среди тех (из этих 25%), кто подвергается повторному заражению, спонтанно излечиваются 80%. При повторной инфекции избавление от вируса у них происходит быстрее, в крови быстрее появляются противовирусные антитела, активнее включается клеточный иммунитет. Механизмы этого протективного иммунитета пока изучены недостаточно, но имеющиеся данные заставили некоторых исследователей пойти нетрадиционным путем. Они попытались создать вакцину, стимулирующую не гуморальный иммунитет — выработку противовирусных антител, а Т-клеточный иммунитет, связанный с формированием Т-клеток, уничтожающих пораженные HCV клетки организма и предотвращающих таким путем дальнейшее распространение вируса.
Группа исследователей под руководством Элеаноры Барнс в сотрудничестве с компанией Glaxo Smith Kline разработала довольно сложную систему вакцинации. На первом этапе предусмотрено введение дефектного по способности к репликации векторного аденовируса обезьян ChAd3, несущего гены нескольких неструктурных белков HCV. В отличие от структурных белков, они более консервативны, а также являются главной мишенью при Т-клеточном иммунном ответе на HCV. Испытания на шимпанзе и на волонтерах показали развитие сильного ответа. Дальнейшее «подстегивание» ответа с помощью введения векторного вируса осповакцины, несущего эти же гены HCV, еще больше усиливало Т-клеточный иммунный ответ и делало его долговременным. Никаких нежелательных побочных эффектов при такой вакцинации отмечено не было. Важным представляется и тот факт, что вследствие вакцинации консервативными неструктурными белками вакцина работала против HCV сразу двух генотипов. Однако, прежде чем эта вакцина будет допущена в медицинскую практику, она должна пройти испытания, которые продлятся 3–4 года.
Источник: ЭЛЕМЕНТЫ БОЛЬШОЙ НАУКИ

