Обобщение данных и поиск закономерностей — одна из важных функций науки. Однако в определенных ее областях имеются трудности с осуществлением этой задачи из-за разнообразия данных. И как раз такая ситуация наблюдается в теломерной биологии. Непредсказуемость динамики теломерной ДНК (тДНК) у новых целевых видов является хорошей иллюстрацией к вышесказанному. Здесь мы расскажем об удивительных результатах, которые получили авторы, исследовавшие теломерную биологию африканской рыбы Nothobranchius furzeri.
Динамика теломер может быть разной. Они могут увеличиваться в длине, уменьшаться или оставаться относительно неизменными у разных организмов. Мимика смайлов отражает судьбу концов хромосом.
Термином «теломеры» в биологии обозначают концевые участки хромосом, для которых характерна неспособность к соединению с другими хромосомами; как следствие, они выполняют функцию «защитных колпачков» для кончиков хромосом. Живой интерес к теломерам по меркам молекулярной биологии возник достаточно давно, но до сих пор область науки, изучающая данные районы хромосом, продолжает преподносить нам сюрпризы. Достаточно давно уже высказана теломерная теория старения, согласно которой процесс клеточного старения является следствием неполного копирования теломерных участков в процессе репликации ДНК и постепенного укорачивания теломер по мере жизни организма. Однако тот факт, что длина теломерной ДНК (тДНК) может со временем как расти, так и уменьшаться у разных организмов (а иногда и у одного и того же организма), требует дополнительного осмысления. С одной стороны, теломеры в эукариотических клетках выполняют универсальные функции — как сами по себе, так и «в компании» белков, РНК и некоторых других молекул. С другой стороны, отсутствие определенной закономерности в динамике теломерной ДНК даже у близких видов говорит возможности существования не только особых механизмов регуляции длины теломер, но и видоспецифичных свойств теломеразы, о которых до сих пор известно очень мало.
Во времена, когда данных о теломерах было, как говорится, кот наплакал, ученые предлагали аргументированные и более или менее стройные теории, объясняющие поведение теломер и суммирующие имеющиеся данные. Однако с ростом экспериментального материала стало понятно, что вся информация о теломерах плохо поддается синтезу, и в итоге от какой-либо центральной закономерности в теломерной биологии вообще отказались. Но до сих пор в специальной (и не очень) литературе можно встретить подтверждение «догмы теломерной биологии», связывающей активность фермента теломеразы и продолжительности жизни (ПЖ) (рис. 1).

Рисунок 1. Догма теломерной биологии. Знаки вопроса над стрелками указывают на существование других вариантов.
Это своего рода отголосок тех поисков истины, но, по сути, последовательность событий на рисунке 1 — лишь частный случай. Если в клетке обнаруживается активная теломераза, то, как правило, длина теломерной ДНК либо увеличивается, либо остается неизменной. В свою очередь длинные теломеры увеличивают репликативный потенциал клетки и позволяют ей жить дольше (по сравнению с другими клетками, лишенными этого волшебного фермента), и наоборот. Однако сейчас хорошо известно, что есть организмы с активной теломеразой и длинными теломерами, но с короткой продолжительностью жизни (например, мыши), а есть, напротив, виды, у которых короткие теломеры и неактивная теломераза, но живут они довольно долго (например, слоны и киты). А есть еще и такие организмы, у которых теломераза активна, а теломеры все равно укорачиваются, и ПЖ небольшая. Это африканская рыба Nothobranchius furzeri, о которой мы дальше и поговорим.
Удивительная рыбка-килли и ее теломеры
Нотобранхиус, или, как ее еще называют, килли (рис. 2), интересна тем, что имеет очень небольшую ПЖ по сравнению с другими позвоночными — всего 3–6 месяцев — и претендует на роль нового модельного организма в геронтологии и биологии индивидуального развития.
Рисунок 2. Место обитания и внешний вид N. furzeri
Кроме того, эта рыбка обитает в условиях, где сезоны дождей сменяются засухой, и водоемы пересыхают. Она вовремя откладывает икру и умирает, а в следующий сезон дождей из икры выходят уже зрелые мальки и начинают быстро расти. Немецкие исследователи из Лейбницкого института изучения старения заинтересовались теломерной биологией двух линий этой рыбки. Одна линия — GRZ (по названию места сбора Gona Re Zhou National Park в Зимбабве) — отличается малой ПЖ: всего 3,5 месяца. Другая линия — MZM-0403 (от Mozambique, в 300 км от предыдущего места сбора) — может жить в два раза дольше. Был поставлен вопрос, зависит ли продолжительность их жизни от длины теломер? Ученые получили довольно неожиданные результаты (рис. 3).
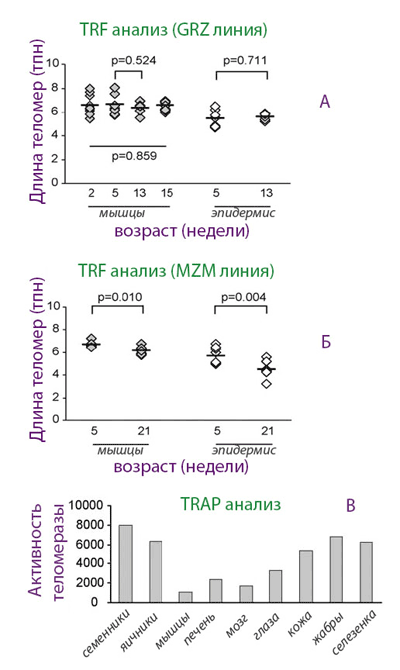
Рисунок 3. Возрастная динамика теломерной ДНК и активность теломеразы в разных тканях у двух линий N. furzeri.
Оказалось, что у короткоживущей линии длина теломер достоверно не изменялась с возрастом, в то время как у долгоживущей линии наблюдалось возрастное уменьшение длины тДНК. Особенно удивительно было то, что у обеих линий теломераза была активна, и, более того, у долгоживущей линии ее активность с возрастом увеличивалась, несмотря на укорочение теломер. Эти данные казались ошеломляющими. Авторы сделали вывод, что старение у нотобранхиуса не связано с регуляцией длины теломер. Другой вывод был сделан относительно теломеразы: этот фермент может иметь функции, не связанные со старением и ПЖ. И данные в пользу последнего уже имеются в науке.
Новые открытия
Если ПЖ у этих двух линий не зависит от длины тДНК, то от чего она зависит? Пытаясь ответить на этот вопрос, авторы продолжили работу и в 2013 г. опубликовали новые результаты. Они начали исследовать культуру фибробластов у этих двух линий и выяснили, что репликативного старения клеток нет ни у короткоживущего, ни у долгоживущего нотобранхиуса! Также авторы показали, что разница в ПЖ у этих линий не связана ни со скоростью пролиферации, ни с пролиферативным потенциалом. Более того, оказалось, что теломераза играет ключевую роль в «отключении» репликативного старения, — то есть, она позволяет клеткам делиться неограниченное число раз. И длина теломер у этих клеток, полученных от обеих линий, не уменьшается в процессе удвоений популяций.
По сути, клетки этой рыбки бессмертны. Если сама рыба живет только 3–6 месяцев, то клетки в культуре существуют уже в течение двух лет и продолжают делиться. Причем морфологически это нормальные клетки, а не раковые! В них не обнаруживается клеточных маркеров старения, хотя на уровне тканей такие молекулярные маркеры уже регистрируются. Авторы делают следующий ошеломляющий вывод — старению подвергаются не клетки, а ткани (как более сложные структуры), — по крайней мере, у этого вида рыб. Но что лежит в основе такого различия? Логично предположить, что регуляция старения осуществляется централизовано, то есть где-то в организме есть центр, отвечающий за данный процесс. Это может хорошо проиллюстрировать ситуация с динамикой тДНК у нотобранхиусов — на уровне ткани (взятой из живого организма) мы наблюдаем одно, а на уровне клеток в культуре — другое.
Источник: БИОМОЛЕКУЛА


